微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
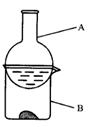
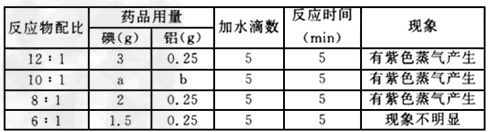
1、实验题 某学生实验小组用如下图装置探究不同配比反应物的用量对碘与铝反应(水做催化剂)的影响,实验数据见下表。?
请回答下列问题: ?
(1)实验装置中A的名称____。 ?
(2)表中a=?_______,b=____。 ?
(3)实验现象中的紫色蒸气是_______,该现象说明铝和碘的反应 ____(填“吸热” 或“放热”)。 ?
(4)依据上表有关数据,分析碘与铝反应最适合学生分组实验操作的配比是____,理由是____________。
(5)实验后有同学想检验该反应的产物就是碘化铝,进行如下实验,请将实验步骤补充完整(所用试剂任选)。?

(6)将提纯后的碘化铝用蒸馏水溶解,分析溶液中碘离子与铝离子的物质的量之比小于3:1的原因(用离子方程式表示)是___________。
参考答案:(1)圆底烧瓶?
(2)2.5?;?0.25?
(3)碘蒸气;?放热?
(4)8:1?;?药品用量少且现象明显,较经济、环保?
(5)
?(6)Al3+ +3H2O  Al(OH)3+3H+
Al(OH)3+3H+
本题解析:
本题难度:一般
2、选择题 不用任何试剂就可鉴别的是( )
A.氨水和AlCl3
B.KAlO2和KHSO4
C.FeCl3和KOH
D.Na2CO3和HNO3
参考答案:A、无论将氨水滴到氯化铝溶液中还是将氯化铝溶液滴到氨水中,都生成白色沉淀,现象相同,所以不能鉴别,故A错误;
B、将偏铝酸钾滴到硫酸氢钾溶液中先无现象后生成白色沉淀,将硫酸氢钾滴到偏铝酸钾溶液中先生成白色沉淀后沉淀消失,二者现象不同,可以鉴别,故B正确;
C、无论将硫酸铁滴到氢氧化钾溶液中还是将氢氧化钾滴到氯化铁溶液中都生成红褐色沉淀,二者现象相同,不能鉴别,故C错误;
D、将碳酸钠滴到硝酸溶液中立即生成气体,将硝酸滴到碳酸钠溶液中先无现象后生成气体,二者现象不同,可鉴别,故D正确.
故选BD.
本题解析:
本题难度:一般
3、填空题 根据要求完成下列各题实验目的.(a、b为弹簧夹,加热及固定装置已略去)
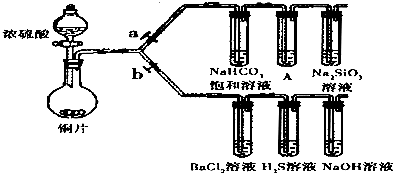
(1)验证碳、硅非金属性的相对强弱.
①实验操作:连接仪器、______、加入药品,打开a关闭b,滴入浓硫酸,加热.
②装置A中发生的化学方程式是______.
③能说明碳的非金属性比硅强的实验现象是:______.
(2)验证?SO2的氧化性、还原性和酸性氧化物的通性.
①H2S溶液中,其发生的离子方程式是______.
②将反应后的BaCl2溶液分成两份,第一份滴加氯水,第二份滴加氨水,则两份溶液中有何现象:______.
③验证SO2的还原性的离子方程式是______.
参考答案:(1)①、装置A中反应制备气体,在加入药品之前需要检验装置的气密性,
故答案为:检验装置的气密性;
②、装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液,反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,
故答案为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
③、利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强,A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强,
故答案为:A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀;
(2)①、H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应离子方程式为:2H2S+SO2=3S↓+2H2O,
故答案为:2H2S+SO2=3S↓+2H2O;
②、应后的BaCl2溶液中含有亚硫酸,亚硫酸被氯水氧化物硫酸,硫酸与氯化钡反应生成硫酸钡,亚硫酸与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成硫酸钡,故都产生白色沉淀,
故答案为:两份溶液中均有白色沉淀生成;
③、二氧化硫被氯水氧化为硫酸,反应中二氧化硫表现还原性,同时与氯化钡反应生成硫酸钡沉淀,故反应离子方程式为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,
故答案为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
本题解析:
本题难度:一般
4、实验题 某实验探究小组根据乙醛还原新制Cu(OH)2的实验操作和实验现象。对反应方程式
“CH3CHO+2Cu(OH)2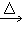 CH3COOH+Cu2O +2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O +2H2O”提出了质疑,并进行如下探究:
(一)查阅资料
(1)质量分数为10%的NaOH溶液密度为1.1 g/cm3,该溶液的c(NaOH)=_________mol/L;质量分数为2%的
CuSO4溶液密度为1.0 g/cm3,其c(CuSO4) =0.125 mol/L。
(2) Cu(OH)2可溶于浓的强碱溶液生成深蓝色的[Cu(OH)4]2-溶液。CuSO4溶液与NaOH溶液反应过程中Cu2+与[Cu(OH)4]2-浓度变化如下图所示:
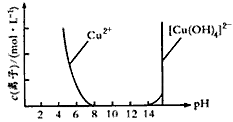
(3)Cu2O、CuO均可溶于CH3COOH;在溶液中可发生2Cu+=Cu+Cu2+反应。
(二)实验操作及实验现象
(1)在2 mL10%的NaOH溶液中滴加4~6滴(约0.2 mL)2% CuSO4溶液,经测定混合溶液中c(OH-)约为 2.5 mol/L。
(2)若对上述混合物进行过滤,可得到浅蓝色的_________ (填化学式)固体,滤液呈深蓝色,则显深蓝色的离子是____________ (填离子符号)。
(3)在第(1)步所得的混合物中加入0.5mL乙醛,加热至沸腾,产生砖红色沉淀。
(三)对"CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O”质疑的理由:
CH3COOH+Cu2O+2H2O”质疑的理由:
(1)______________; (2)________________
(四)结论:根据上述探究,乙醛与新制Cu(OH)2反应的离子方程式为____________________
参考答案:(一)(1)2.75
(二)(2)Cu(OH)2;[Cu(OH)4]2-
(三)(1)在强碱性溶液中,CH3COOH与OH-反应,CH3COOH应以CH3COO-形式存在
(2)CH3COOH与Cu2O要发生反应,不可共存(其他合理答案也得分)
(四)CH3CHO+2Cu(OH)2+OH- CH3COO-+Cu2O↓+3H2O或CH3CHO+2[Cu(OH)4]2-
CH3COO-+Cu2O↓+3H2O或CH3CHO+2[Cu(OH)4]2- CH3COO-+Cu2O↓
CH3COO-+Cu2O↓
+3H2O+3OH-
本题解析:
本题难度:困难
5、选择题 下列有关实验操作的说法正确的是:
A.中和反应反应热的测定实验中,用温度计测完盐酸的温度后,直接继续测量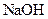 溶液的温度
溶液的温度
B.中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铁丝搅拌棒,不影响反应热的测定
C.用50ml酸式滴定管可准确量取25.00ml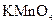 溶液
溶液
D.用PH试纸测定溶液的PH时,需先用蒸馏水润湿试纸
参考答案:C
本题解析:略
本题难度:简单