微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
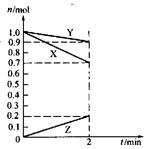
1、选择题 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:该反应的化学方程式为_________________。反应开始至2min,用Z表示的平均反应速率为____________。
参考答案:3X+Y=2Z?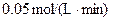
本题解析:由图可知,X、Y的物质的量随反应的进行而减小,Z的物质的量随反应的进行而增大,则X和Y为反应物,Z为生成物。
∵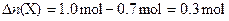
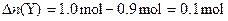
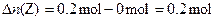
∴反应方程式为:3X+Y=2Z。
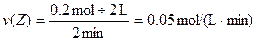
本题难度:一般
2、选择题 一定条件下,在密闭恒压容器中,能表示反应X(g)+2Y(g)

?2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2;②Z的浓度不再发生变化;③容器中的压强不再发生变化;④单位时间内生成n?molZ,同时生成2n?molY;⑤容器中的气体平均相对分子质量不再发生变化;⑥容器中气体的密度不再发生变化.
A.①②
B.①③⑤
C.②⑤⑥
D.②③⑤
参考答案:①平衡时各物质的物质的量与反应初始物质的量及转化率有关,和化学方程式的系数无关,故①错误;
②反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,所以Z的浓度不再变化时,该反应达到平衡状态,故②正确;
③该反应是反应前后气体体积有变化的反应,但是该反应是在恒压条件下发生,所以容器中的压强不再发生变化,不能证明达到了平衡状态,故③错误;
④单位时间内生成nmolZ,反应是向右进行的,同时生成2nmolY,则反应向左进行,但是正逆反应速率是不相等的,故④错误;
⑤容器中的气体平均相对分子质量M=mn,反应前后混合气体的质量始终不变,该反应是一个反应前后物质的量变化的反应,所以当M不再发生变化时,表明已经平衡,故⑤正确;
⑥该容器的压强保持不变,所以容积变,根据质量守恒定律知,反应前后混合气体的质量始终不变,所以容器内气体的密度始终变,当容器中气体的密度不再发生变化时,表明达到化学平衡状态,故⑥正确.
故选C.
本题解析:
本题难度:一般
3、填空题 分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I? SO2+2H2O+I2→H2SO4+2HI?
II? 2HI H2+I2
H2+I2
III? 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________?
a.反应III易在常温下进行? b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O?d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。
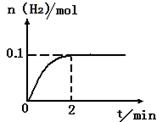
0—2min内的平均反应速率v(HI)= _________?。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数? b.HI的平衡浓度?
c.达到平衡的时间?d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
 ?
?
实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
参考答案:(1)bc(2分)
(2)0.05mol·L-1·min-1; ;b (各1分)
;b (各1分)
(3)bd;五氧化二钒、500℃;加快反应速度。(共5分)?
(4)a/116×18.4~a/198×18.4 (2分)
本题解析:(1)a.反应III2H2SO4 → 2SO2+O2+2H2O是分解反应,要在高温下进行。b.根据还原剂的还原性强于还原产物的还原性,故反应I中SO2还原性比HI强,正确。c.水在循环过程中始终消耗,故需补充H2O,正确。d.根据电子守恒,循环过程中产生1molO2转移4mol电子,同时产生2molH2,错误。故选bc。
(2)根据平均反应速率v(HI)="2v(H2)=2*0.1/(2*2" )= 0.05mol·L-1·min-。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数表达式为K=
H2(g)+I2(g)的平衡常数表达式为K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,根据反应前后体积不变这个特点可知与原平衡是等效平衡,则HI的平衡浓度是原来的2倍,而平衡常数只与温度有关,温度不变,平衡常数也不变,平衡时H2的体积分数相同。
。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,根据反应前后体积不变这个特点可知与原平衡是等效平衡,则HI的平衡浓度是原来的2倍,而平衡常数只与温度有关,温度不变,平衡常数也不变,平衡时H2的体积分数相同。
(3)根据反应2SO2 (g) + O2(g)  2SO3(g) + Q的特点,正反应体积减小,放热反应,故关系图正确的是bd。实际工业生产还要根据设备的成本,反应速率及催化剂的适宜温度综合考虑故使用的条件是:常压、五氧化二钒、500℃;选择该条件的原因是加快反应速度。
2SO3(g) + Q的特点,正反应体积减小,放热反应,故关系图正确的是bd。实际工业生产还要根据设备的成本,反应速率及催化剂的适宜温度综合考虑故使用的条件是:常压、五氧化二钒、500℃;选择该条件的原因是加快反应速度。
(4)亚硫酸的铵盐正盐和酸式盐两种情况。若a克分别是两种铵盐时,应加入18.4 mol/L的硫酸溶液的体积设为v,则
(NH4)2SO3? -----H2SO4? 2NH4HSO3----H2SO4
a/116? a/116? a/99? a/198
v=a/116×18.4? v=a/198×18.4,应加入18.4 mol/L的硫酸溶液的体积范围为a/198×18.4----a/116×18.4。
本题难度:困难
4、选择题 某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质
| X
| Y
| Z
| W
|
初始浓度/mol·L-1
| 0.5
| 0.6
| 0
| 0
|
平衡浓度/mol·L-1
| 0.1
| 0.1
| 0.4
| 0.6
|
?
A.反应达到平衡时,X的转化率为80%?
B.该反应的平衡常数表达式为K=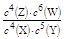
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:根椐化学计量数的比为反应速率之比,可知,该题中反应物是X和Y,生成物是Z和W,可知化学计量数为:4、5、4、6,也是说反应方程式为:4X+5Y 4Z+6W。可知,当增大压强时,平衡向逆向移动,使得Z的含量减少。因此C错误。
4Z+6W。可知,当增大压强时,平衡向逆向移动,使得Z的含量减少。因此C错误。
本题难度:一般
5、填空题 (6分) 右图表示800℃时,一个反应体系内A、B、C三种气体物质的浓度随时间变化的情况,t是反应时间。请回答:
(1)该反应的反应物是______。
(2)该反应的化学方程式为_?_____。
(3)达到平衡状态的所需时间是2min,则该2min内A物质的平均反应速率为___? ____。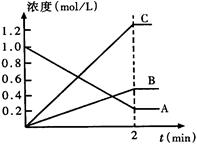
参考答案:(1)A (2)2A 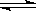 ?B + 3C?(3)0.4 mol·mol-1·min-1
?B + 3C?(3)0.4 mol·mol-1·min-1
本题解析:略
本题难度:简单