微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘单质反应(H2+I2=2HI)生成1 mol HI需要 (填“放出”或“吸收”) ___ kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。

在如图甲装置中,负极电极反应式为 ,发生的是 反应(填“氧化”或“还原”,下同)。正极电极反应式为 ;总反应的离子方程式为 。
(3)若用氢氧化钾溶液做电解质溶液,用氢气做燃料,空气做氧化剂制成燃料电池,其负极反应式为 ;正极反应式为 。当有标状下2.24L氢气消耗时,另一极消耗氧气的物质的量为 。
(4)在如下图所示的原电池中,铝做 极,导线上电子由 极流向 极。
参考答案:(12分)(1)放出;5.5
(2)Zn—2e—=Zn2+;氧化;2H++2e—=H2↑;Zn+2H+=Zn2++H2↑
(3)2H2—4e—+4OH—=4H2O;O2+4e—+2H2O=4OH—;0.05mol
(4)负;铝;镁(或负;正)
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据键能可知,该反应的反应热=436 kJ/mol+151 kJ/mol-299 kJ/mol×2=-11kJ/mol,所以生成1 mol HI需要放出5.5kJ的热量。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,则锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子,析出氢气。
(3)氢气在负极通入,由于溶液是碱性溶液,所以负极电极反应式是2H2—4e—+4OH—=4H2O;氧气在正极通入,电极反应式是O2+4e—+2H2O=4OH—;标准状况下2.24L氢气是0.1mol,失去0.2mol电子,所以根据电子的得失守恒可知,需要氧气的物质的量是0.2mol÷4=0.05mol。
(4)镁的金属性强于铝的,但能和氢氧化钠溶液反应的是铝,所以铝是负极,镁是正极,导线上电子由铝电极流向镁电极。
考点:考查反应热的计算、原电池的有关应用、判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,贴近高考,旨在培养学生分析、归纳、总结问题的能力,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
2、选择题 以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+5/2O2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是
[? ]
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
参考答案:AD
本题解析:
本题难度:简单
3、填空题 (1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:

①a、b、c分别代表什么意义?
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH
反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
H2(g) H2(l) ΔH=-0.92 kJ·mol-1
H2(l) ΔH=-0.92 kJ·mol-1
O2(g) O2(l) ΔH=-6.84 kJ·mol-1
O2(l) ΔH=-6.84 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
参考答案:(1)①1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量 H、O结合生成1 mol H2O(g)放出的热量 1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量
②放热 <
(2)相同质量时,氢气放出的热量多 产物为水,无污染(其他合理答案均可)
(3)H2(l)+O2(l) H2O(g) ΔH=-237.46 kJ·mol-1
H2O(g) ΔH=-237.46 kJ·mol-1
本题解析:(1)化学反应是旧键断裂(吸热)和新键生成(放热)的过程。该反应是吸热还是放热要看这两个过程中能量变化的相对大小。
(3)根据题中所给数据,可求出H2(l)+O2(l) H2O(g)的焓变ΔH的数值,ΔH=(-285.8+0.92+×6.84+44.0) kJ·mol-1=-237.46 kJ·mol-1。
H2O(g)的焓变ΔH的数值,ΔH=(-285.8+0.92+×6.84+44.0) kJ·mol-1=-237.46 kJ·mol-1。
考点:化学反应与能量
本题难度:一般
4、填空题 (11分)(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+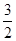 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。

①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
参考答案:(11分)
(1)3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1(2分)
不能(1分) 该反应为引发反应,需消耗大量能量,成本高(2分)
(2)吸(1分) 增大(1分) D (2分)
(3)409kJ/mol(2分)
本题解析:(1)根据盖斯定律Al与FeO的反应的热效应ΔH=②-3①=-1675.7 kJ·mol-1-3(-272.0 kJ·mol-1)=-859.7kJ/mol,所以该反应的热化学方程式为3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1;该反应不能用于工业炼铁,因为用该反应炼铁时需消耗大量冶炼成本更高的Al,消耗大量能量,成本高,无经济效益;
(2)①该反应的反应物的总能量低于生成物的总能量所以是吸热反应;升高温度,正逆反应的速率都增大;②B的历程说明,没改变反应热,但降低了该反应的活化能,所以是使用了催化剂,答案选D;
(3)活化能是反应物的总能量与反应时的最高能量的差值,逆反应的反应物即正反应的生成物,所以逆反应的活化能=正反应的活化能+逆反应的反应热=167.2+241.8=409kJ/mol。
考点:考查盖斯定律的应用,活化能的计算
本题难度:一般
5、填空题 饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:?
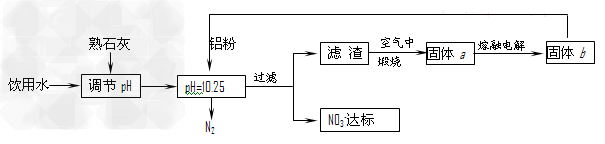
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为 __________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、___ _______________,在调节pH时,若pH过大或过小都会造成____________的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___________________________。
⑷饮用水中的NO3-?主要来自于NH4+。已知在微生物作用的条件下,NH4+?经过两步反应被氧化成NO3-?。两步反应的能量变化示意图如下:试写出1?mol?NH4+?(aq)全部氧化成NO3-?(aq)的热化学方程式是______________。

参考答案:⑴10Al+6NO3-+18H2O==10Al(OH)3+3N2↑+6OH-
⑵引入的Ca2+对人体无害;来源丰富、价格便宜;铝
⑶5H2+2NO3-?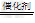 N2+4H2O+2OH-
N2+4H2O+2OH-
⑷NH4+?(aq)+2O2(g)?==2H+(aq)+NO3-?(aq)+H2O(l)?△H?=-346?kJ·mol-1
本题解析:
本题难度:一般