| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《热化学方程式》高频考点强化练习(2017年最新版)(四)
参考答案:D 本题解析:根据题意,求C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)的△H,根据盖斯定律可得,该反应的△H=③-②+3①=-(Q3- Q2+3 Q1),23g乙醇的物质的量是0.5mol,所以放出的热量是(Q3- Q2+3 Q1)的1/2,即1.5Q1-0.5Q2+0.5Q3,答案选D。 本题难度:一般 2、选择题 己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ/mol。 则HCN在水溶液中电离的△H等于 ( ) |
参考答案:C
本题解析:根据能量守恒定律可知,HCN在水溶液中电离的焓变ΔH等于-12.1 kJ·mol-1+55.6 kJ·mol-1=+43.5 kJ·mol-1,答案选C。
考点:考查盖斯定律的有关应用。
本题难度:一般
3、填空题 (10分)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g) △H=a kJ?mol-1
②3AlCl(g)= 2Al(l)+ AlCl3(g) △H=b kJ?mol-1
反应Al2O3(s)+ 3C(s)=2Al(l)+ 3CO(g)的△H= kJ?mol-1(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)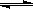 N2(g)+ CO2(g) △H="Q" kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H="Q" kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 时间(min) 时间(min)浓度 (mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
参考答案:(1)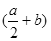
(2)①0.25 ②a d ③ < ④b c
本题解析:(1)根据盖斯定律,△H=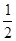 ①+②=
①+②=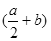 ;(2)①根据表格数据,20min、40min反应分别达到平衡状态,
;(2)①根据表格数据,20min、40min反应分别达到平衡状态,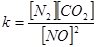 =
=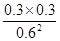 =0.25;②30min ~ 40min各物质的浓度均增大,所以改变的条件为通入一定量的NO 、适当缩小容器的体积。③30min NO、N2、CO2的浓度之比为2:1:1,升高温度NO、N2、CO2的浓度之比变为3:1:1,所以平衡逆向移动,故该反应放热,Q<0;④单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g),都指V(逆),故A错误;温度为反应过程的变量,温度不再发生改变说明达到平衡,故B正确;
=0.25;②30min ~ 40min各物质的浓度均增大,所以改变的条件为通入一定量的NO 、适当缩小容器的体积。③30min NO、N2、CO2的浓度之比为2:1:1,升高温度NO、N2、CO2的浓度之比变为3:1:1,所以平衡逆向移动,故该反应放热,Q<0;④单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g),都指V(逆),故A错误;温度为反应过程的变量,温度不再发生改变说明达到平衡,故B正确;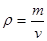 ,反应过程中气体质量变化,所以密度为反应过程的变量,混合气体的密度不再发生改变达到平衡状态。
,反应过程中气体质量变化,所以密度为反应过程的变量,混合气体的密度不再发生改变达到平衡状态。
考点:本题考查化学平衡。
本题难度:困难
4、填空题 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3
参考答案:
本题解析:
本题难度:困难
5、填空题 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol?H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为______.
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______.
参考答案:(1)反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为256.7KJ0.4=641.75kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;
依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75KJ/mol,
16g液态肼物质的量=16g32g/mol=0.5mol,
所以16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875KJ,故答案为:408.875;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染,故答案为:产物不会造成环境污染.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《金属的腐蚀.. | |