微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH="-196.6" kJ/mol。
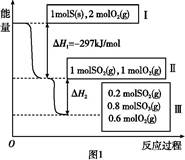
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比
参考答案:
本题解析:
本题难度:困难
2、选择题 已知在25℃,101kPa下,l gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
[? ]
A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
参考答案:B
本题解析:
本题难度:一般
3、填空题 (12分) 金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,
该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)下图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
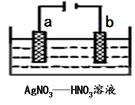
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 ,其总反应式为: 。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g) △H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
参考答案:(1)b d (2分) (2) Cu2S, 4 (各1分) (3)a (1分), NO3— + 2H+ + e— =NO2 ↑+H2O(2分)
(4)①导电(或),②水参与了化学反应(答出其中任一点即得1分),
3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag(2分) (5)-25kJ/mol (2分)
本题解析:(1)金属的冶炼有三种方法,依据金属或顺序在K-Al采用电解法,Zn-Cu采用热还原法,Hg以后采用热分解法。故选择b d;(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,分析化合价,可知Cu2S的中的Cu和S元素的化合价均升高,故Cu2S为还原剂,氧气的化合价降低,所以O2是氧化剂,每个氧原子转移2电子,因为氧气是双原子分子,故得电子为4mol电子,所以还原剂失电子也为4mol;(3)图微电解池,从图可知a为阳极,发生氧化反应,b为阴极,发生还原反应,粗银要变为高纯银则在阳极a处电极反应为:Ag - e-=Ag+;若b极有少量红棕色气体生成,可以推断是生成了NO2气体,故可知是NO3在发生还原反应,NO3— + 2H+ + e— =NO2 ↑+H2O,此处与阴极聚集阳离子发生还原反应的规律违背,切记若乱放电,则需要仔细分析题目所给信息。(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,显然题目在考查原电池的构成条件,食盐水的作用为做电解质溶液,仔细分析题目可以确定反应物为Ag2S、Al,产物中有Ag单质,结合化合价的升降原则,巧用水,可知反应的3Ag2S+2Al+3H2O=2Al(OH)3+3H2S↑+6Ag。(5)考查盖斯定律,根据目标方程式: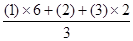 故
故
△H=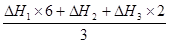 = -25kJ/mol
= -25kJ/mol
考点:金属性的冶炼 氧化还原反应 原电池的构成条件 电解池 盖斯定律
点评:本题是一道无机综合题,考查同学们的分析问题的能力,难度中等,其中涉及金属的冶炼,氧化还原反应,电化学以及盖斯定律等知识,需要同学们对题目所给的信息结合所学的知识点进行加工处理。
本题难度:困难
4、选择题 有三个热化学方程式:其中Q1、Q2、Q3的大小关系为( )
①2H2?(g)+O2?(g)=2H2O?(g)+Q1?kJ;
②2H2?(g)+O2?(g)=2H2O?(l)+Q2?kJ;
③H2?(g)+
O2?(g)=H2O?(g)+Q3?kJ.
A.Q1=Q2=Q3
B.2Q3=Q1<Q2
C.Q3<Q2<Q1
D.Q1<Q2<3Q3
参考答案:B
本题解析:
本题难度:一般
5、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。

①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)

(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
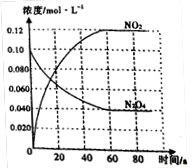
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
参考答案:(1)① <(1分) ②逐渐减小(1分) (2)A(2分)
(3)① 0.0020(2分) ②>(2分)
③反应达平衡时N2O4的浓度减少0.0020 mol/(L·s) ×10s=0.020 mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
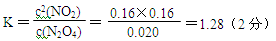
(4)负极(1分) 3O2+ 6H2O + 12e-=12OH-(2分)
本题解析:(1)①反应是气体体积减少的反应,温度相同时压强越大,平衡向正向移动,NO的转化率就越大,P2下的转化率比P1大,故P2较大,则P1<P2,②压强相等时,温度升高NO的转化率减小。故升高温度平衡向逆向移动,平衡常数减小。(2)反应的△H<0,所以反应是放热反应,NO2的能量较高,同种物质气态的能量比液态高,故A对。(3)①从图看出0~60s 时段,NO2的浓度改变了0.12mol/L,则NO2反应速率为:0.12mol/L÷60s=" 0.0020" mol/(L·s)。 ②2NO2(g) N2O4(g) △H<0则N2O4(g)
N2O4(g) △H<0则N2O4(g) 2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
N2O4(g)  2NO2(g)
2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
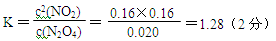
(4)从反应方程式看出N 的化合价升高,失去电子,故在负极反应;NH3在负极反应,那么O2在正极反应,电解质溶液是碱性的,电极反应为:3O2+ 6H2O + 12e-=12OH-(2分)
考点:化学平衡图像、化学平衡的移动、化学平衡常数的计算、燃料电池的工作原理。
本题难度:困难