微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH="-196.6" kJ/mol。
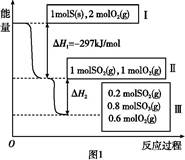
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比
2、选择题 已知在25℃,101kPa下,l gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
[? ]
A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
3、填空题 (12分) 金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,
该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)下图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
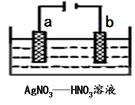
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 ,其总反应式为: 。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g) △H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
4、选择题 有三个热化学方程式:其中Q1、Q2、Q3的大小关系为( )
①2H2?(g)+O2?(g)=2H2O?(g)+Q1?kJ;
②2H2?(g)+O2?(g)=2H2O?(l)+Q2?kJ;
③H2?(g)+
O2?(g)=H2O?(g)+Q3?kJ.
A.Q1=Q2=Q3
B.2Q3=Q1<Q2
C.Q3<Q2<Q1
D.Q1<Q2<3Q3
5、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。

①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)

(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
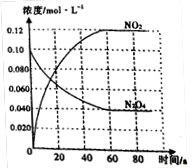
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________