|
|
|
高考化学必考知识点《热化学方程式》在线测试(2017年最新版)(三)
2017-08-22 15:50:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:______
(2)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为______
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO(g)还原FeO(s)得到Fe(s)体和CO2(g)的热化学反应方程式:______.
2、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
A.CH3OH(l)+3/2O2(g)→CO2(g)+2H2O(l)△H="+725.8" kJ/mol
B.2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H="+1452" kJ/mol
|
3、选择题 含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式是( )
A.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4kJ/mol
4、填空题 (14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)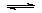 2SO3(g) ΔH= -196.6kJ·mol-1 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)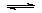 2NO2(g) ΔH= -113.0kJ·mol-1 2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)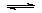 SO3(g)+NO(g)的ΔH= kJ·mol-1。 SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
|
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=
。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
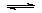
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是:
。
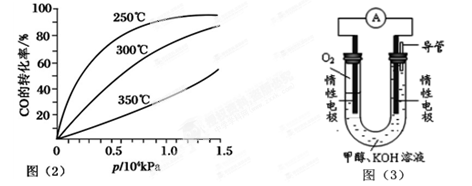
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH-向
极移动(填“正”或“负”)。
② 该电池正极的电极反应式为
。
5、填空题 (14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJ?moL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJ?moL-1
H2O(g)=H2O(l) △H=—44.0kJ?moL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。
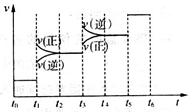
①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。
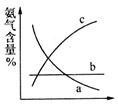
当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol

