微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)(1)常温下,已知0.1 mol·L—1一元酸HA溶液中c(OH-)/c(H+)=1×10—8,则溶液的pH=_____________。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+ c(HA)— c(OH-)=" ____________" mol·L—1。
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
2、填空题 (6分)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
| 起始浓度/(mol·L-1)
| 反应后溶液的pH
|
c(HA)
| c(KOH)
|
①
| 0.1
| 0.1
| 9
|
②
| x
| 0.2
| 7
|
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
3、填空题 【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
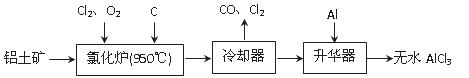
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
4、选择题 NH4Cl溶液中,离子浓度由大到小的顺序正确的是
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(H+)>c(OH-)>c(NH4+)>c(Cl-)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)