微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)(1)常温下,已知0.1 mol·L—1一元酸HA溶液中c(OH-)/c(H+)=1×10—8,则溶液的pH=_____________。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+ c(HA)— c(OH-)=" ____________" mol·L—1。
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
参考答案:(1)3 ①HA+H+ A—+H2O; c(A—)>c(Na+) >c(H+) >c(OH-);②0.05 mol·L—1。
A—+H2O; c(A—)>c(Na+) >c(H+) >c(OH-);②0.05 mol·L—1。
(2)1×10—13。①12;②pHa+pHb=12。
本题解析:(1)常温下,已知0.1 mol·L—1一元酸HA溶液中c(OH-)/c(H+)=1×10—8,而Kw= c(OH-)·c(H+)=1×10—14,c(H+)=1×10—,3则溶液的pH=3。①0.1 mol·L—1一元酸HA溶液的pH=3则HA为弱酸,pH=3的HA与pH=l1的NaOH溶液等体积混合反应的离子方程式为HA+H+ A—+H2O;HA远过量,混合溶液为HA和NaA的混合液,溶液呈酸性,各离子的物质的量浓度大小关系是c(A—)>c(Na+) >c(H+) >c(OH-);②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液为浓度均为0.05 mol·L—1的HA和NaA的混合液,物料守恒为:c(HA)+ c(A—)=" 0.1" mol·L—1,电荷守恒式为c(H+)+ c(Na+)= c(A—)+ c(OH-),c(Na+)=" 0.05" mol·L—1则c(H+)+ c(HA)— c(OH-)=" 0.05" mol·L—1。(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,硫酸中氢离子浓度和氢氧化钠溶液氢氧根离子浓度相等,均为10—2 mol·L—1,又氢氧化钠溶液中氢离子浓度为10—11 mol·L—1,则该温度下水的离子积常数Kw=1×10—13。①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后氢氧化钠过量,混合液中c(OH-)=(100mL×0.4 mol·L—1—100mL×0.2 mol·L—1)÷200mL="0.1" mol·L—1,c(H+)=" Kw" / c(OH-) =10—12 mol·L—1,溶液的pH=12;②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则10—pHa=10×10 pHb—13,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是pHa+pHb=12。
A—+H2O;HA远过量,混合溶液为HA和NaA的混合液,溶液呈酸性,各离子的物质的量浓度大小关系是c(A—)>c(Na+) >c(H+) >c(OH-);②0.2 mol·L—1HA溶液与0.1 mol·L—1NaOH溶液等体积混合后所得溶液为浓度均为0.05 mol·L—1的HA和NaA的混合液,物料守恒为:c(HA)+ c(A—)=" 0.1" mol·L—1,电荷守恒式为c(H+)+ c(Na+)= c(A—)+ c(OH-),c(Na+)=" 0.05" mol·L—1则c(H+)+ c(HA)— c(OH-)=" 0.05" mol·L—1。(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,硫酸中氢离子浓度和氢氧化钠溶液氢氧根离子浓度相等,均为10—2 mol·L—1,又氢氧化钠溶液中氢离子浓度为10—11 mol·L—1,则该温度下水的离子积常数Kw=1×10—13。①该温度下(t℃),将100mL0.1 mol·L—1的稀H2SO4与100mL0.4 mol·L—1的NaOH溶液混合后氢氧化钠过量,混合液中c(OH-)=(100mL×0.4 mol·L—1—100mL×0.2 mol·L—1)÷200mL="0.1" mol·L—1,c(H+)=" Kw" / c(OH-) =10—12 mol·L—1,溶液的pH=12;②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则10—pHa=10×10 pHb—13,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是pHa+pHb=12。
考点:考查水的电离和溶液的酸碱性。
本题难度:困难
2、填空题 (6分)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
| 起始浓度/(mol·L-1)
| 反应后溶液的pH
|
c(HA)
| c(KOH)
|
①
| 0.1
| 0.1
| 9
|
②
| x
| 0.2
| 7
|
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
参考答案:(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中离子浓度由大到小的顺序是 。(1) HA  H+ +A- (2) > < < (3) c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)
H+ +A- (2) > < < (3) c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)
本题解析:
试题解析:(1)物质的量浓度体积相等HA和氢氧化钾混合,二者恰好反应生成盐,混合溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;(2)KA是强碱弱酸盐,其溶液呈碱性,要使酸碱混合溶液呈中性,则酸应该稍微过量,即酸的物质的量浓度应稍大于0.1mol/L,根据物料守恒可得:c(A-)+c(HA) >0.1mol·L-1;室温下,将pH=3的HA溶液进行稀释,稀释过程中,HA的电离平衡向正向移动,削弱氢离子浓度的减小程度,则稀释到原体积的10倍后,氢离子浓度大于原浓度的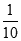 ,PH<4;室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则盐酸与氢氧化钠恰好完全中和,HA稍微过量,但因为HCl是强电解质,完全电离,HA是弱电解质,微弱电离,盐酸中氢离子浓度大于HA,a室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性a<b。(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后,得到等浓度的NaA、NaCl和HA的混合溶液,溶液呈酸性,溶液呈酸性,则NaA的水解程度小于HA的电离程度,故所得溶液中离子浓度由大到小的顺序是:c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)。
,PH<4;室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则盐酸与氢氧化钠恰好完全中和,HA稍微过量,但因为HCl是强电解质,完全电离,HA是弱电解质,微弱电离,盐酸中氢离子浓度大于HA,a室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性a<b。(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后,得到等浓度的NaA、NaCl和HA的混合溶液,溶液呈酸性,溶液呈酸性,则NaA的水解程度小于HA的电离程度,故所得溶液中离子浓度由大到小的顺序是:c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)。
考点:弱电解质的电离、盐类水解
本题难度:困难
3、填空题 【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
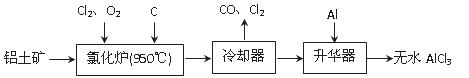
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
参考答案:(1)Al2O3+3Cl2+3C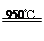 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2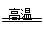 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)
本题解析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2
本题难度:困难
4、选择题 NH4Cl溶液中,离子浓度由大到小的顺序正确的是
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(H+)>c(OH-)>c(NH4+)>c(Cl-)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)