微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某中学化学研究性学习小组利用以下装置制取并探究氨气的性质
[A中发生反应的化学方程式:2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2] 。
2NH3↑+2H2O+CaCl2] 。

【实验探究】
(1)A中的反应___(填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取____气体(只填一种)。
(3)若有10.7 g NH4Cl固体,最多可制取NH3(标准状况)的体积是____L(NH4Cl 的摩尔质量为53.5
g·mol-1)。
(4)实验室收集氨气的方法是___。
(5)C、D装置中颜色会发生变化的是___(填“C”或“D”)。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是____(填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 ___物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物)
B.NaOH固体
C.硫酸溶液
D.石灰石(CaCO3)
【知识应用】
(9) 2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救方法?
参考答案:(1)不是
(2) O2(或氧气,其他合理答案即可)?
(3)4. 48
(4)向下排空气法
(5)D
(6)有白烟生成
(7)F
(8)A B
(9)
①用湿毛巾捂住口鼻,并迅速撤离。
②低头弯腰,往低处跑,迅速撤离。
③逆风奔跑,迅速撤离。
④戴上防毒面具,迅速撤离。
本题解析:
本题难度:一般
2、实验题 (14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
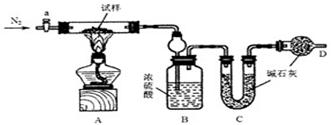

实验过程
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计 ):
):
(1)装置A中发生反应的化学方程式为?▲?。
(2)装置B的作用为?▲?。
装置C的作用为?▲?。
(3)实验过程中通入N2的目的为?▲?。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是(?▲?)(填选项字母)
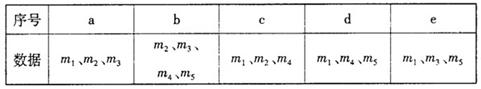
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3)?▲?(填“能”或“不能”)。若能,则w(NaHCO3)的计算式为:?▲?,若不能,此问不作答。
参考答案:
(1)2NaHCO3 Na2CO3 + CO2 + H2O (2分)、NH4HCO3
Na2CO3 + CO2 + H2O (2分)、NH4HCO3 NH3+ CO2+H2O (2分)
NH3+ CO2+H2O (2分)
(2)吸收反应生成的水蒸气和氨气(1分) ;吸收反应生成的CO2 (1分);
(3)把装置中的CO2、NH3和水蒸气排出,使其被装置B和装置C完全吸收(2分)
(4)b、c 、e? (3分,每项1分,选错一项倒扣一分,本题最低分0分)?;
(5)能(1分);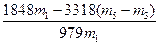 ×100% 或 等价表达式 (2分)
×100% 或 等价表达式 (2分)
本题解析:略
本题难度:一般
3、实验题 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为?。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
实验
编号
| 反应温度
(利用水浴加热)
| 稀硫酸
溶液
| MnSO4固体
| 0.10 mol/L
KMnO4溶液
| 褪色
时间
|
1
| 750C
| 一
| 一
| 1mL
| 100s
|
2
| 750C
| 10滴
| 一
| 1mL
| 40s
|
3
| 750C
| 10滴
| 加入少许
| 1mL
| 3s
|
甲同学由此能够得出结论:??
II.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”, 决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸。
(1) 欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液。每次移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,滴定实验重复操作2 —3次。平均消耗标准溶液V mL。
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为?。(只列式不计算,已知:C2O42-的的摩尔质量为88 g?mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是??。
参考答案:I.(1)5H2C2O4+2MnO4?+6H+=2Mn2++10CO2↑+8H2O
(2)随着草酸溶液与高锰酸钾溶液反应的进行,生成了Mn2+,Mn2+作为该反应的催化剂,可以加快化学反应速率。
II.(1)②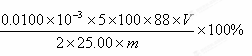
③菠菜中还含有其他还原性物质,能与KMnO4反应
本题解析:I.(1)高锰酸钾溶液具有氧化性,能氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
(2)图表中高锰酸钾溶液加热,褪色时间较长,加入少许硫酸锰速率增大较快,反应需要的时间缩短,Mn2+起到催化作用,加入稀硫酸褪色时间缩短,说明生成的锰离子对分解起了催化作用。
II.(1)②依据反应的离子方程式计算,设草酸物质的量为x:
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5? 2
x? 0.0100mol/L×v×10-3L
可得菠菜中草酸盐(以C2O42-计)的质量分数为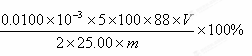
③用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液中可能含有其他还原性物质会消耗高锰酸钾,导致结果可能偏高。
本题难度:一般
4、选择题 下列有关实验操作、现象和解释或结论都正确的是 (? )
选项
| 实验操作
| 现象
| 解释或结论
|
A
| 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
| 溶液呈红色
| 稀HNO3将Fe氧化为Fe3+
|
B
| AgI沉淀中滴入稀KCl溶液
| 有白色沉淀出现
| AgCl比AgI更难溶
|
C
| 常温下,向饱和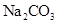 溶液中加少量 溶液中加少量 粉末,过滤,向洗净的沉淀中加稀盐酸 粉末,过滤,向洗净的沉淀中加稀盐酸
| 有气泡产生
| 不能说明常温下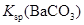
与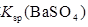 的大小关系 的大小关系
|
D
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上
| 试纸变蓝色
| 浓氨水呈碱性
参考答案:CD
本题解析:
正确答案:C、D
A、3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O,无Fe3+,滴入KSCN溶液,不呈红色。
B、AgCl+I―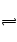 AgI+Cl―是可逆反应。 AgI+Cl―是可逆反应。
C、CO32―+BaSO4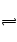 BaCO3+SO42―,是可逆反应,所以结论正确。 BaCO3+SO42―,是可逆反应,所以结论正确。
D、现象和结论均正确。
本题难度:简单
5、选择题 下列结论正确的是?(?)
参考答案:D
本题解析:略
本题难度:一般
|