微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污? b.溶解镀锌层? c.去除铁锈? d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液? b.KSCN溶液? c.溶液KMnO4? d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O
①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
参考答案:(1)ab?(2)c?(3)N2气氛下,防止Fe2+被氧化?(4)①Fe2+、S2O32-?②22.4
本题解析:(1)根据信息“Zn及化合物的性质与Al及化合物的性质相似”知,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,选ab;
(2)溶液B中含有Fe3+和Fe2+,要检验其中的Fe2+要利用其还原性,能使溶液KMnO4溶液褪色,选c;
(3)Fe2+具有较强的还原性,易被氧化,持续通入N2,防止Fe2+被氧化;
(4)①反应过程中铁元素的化合价由Fe2+中的+2价升高到Fe3O4中的+3价,硫元素的化合价由S2O32-中的+2价升高到S4O62-中的+2.5价,Fe2+和S2O32-被氧化作还原剂;②反应过程中铁元素的化合价由Fe2+中的+2价升高到Fe3O4中的+3价,硫元素的化合价由S2O32-中的+2价升高到S4O62-中的+2.5价,产生的Fe3O4(胶体)与S4O62-均为1mol,失去的电子共4 mol,根据得失电子守恒知,参加反应的O2为1mol,标准状况下的体积为22.4L。3O4胶体粒子及副产物ZnO”为载体,考查化学实验基本操作,涉及溶液配制仪器的选择、Fe2+的检验及氧化还原反应相关知识。
本题难度:一般
2、选择题 某酸性溶液中可能含有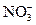 、I-、Cl-、Fe3+中的一种或几种离子,向其中加入溴水,溴水褪色,下列推测不正确的是
、I-、Cl-、Fe3+中的一种或几种离子,向其中加入溴水,溴水褪色,下列推测不正确的是
A.一定含I-
B.不含Fe3+
C.一定含Cl-
D.不含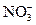
参考答案:C
本题解析:溴水褪色,一定含I-,Fe3+、NO-3(H+)不能与I-共存,一定无Fe3+、NO-3,Cl-不能确定。
本题难度:简单
3、实验题 (9分)如图是某同学设计的放热反应的观察装置。
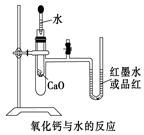
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水 (或品红)溶液。打开T型管?螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:(1)实验中观察到的现象是?
(2)该实验中必须进行的一步实验操作是?
(3)该实验的原理是
________________________________________________________________________
(4)实验中反应的化学反应方程式是?
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系?
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?____。
参考答案:(9分)(1)U形玻璃管里的红墨水(或品红)会沿开口端上升(2分)?
(2)检查装置气密性 (1分)
(3)CaO和水反应放出热量使大试管中空气膨胀,压强增大,引起红墨水(或品红)在U形管中的液面不再相平 (2分)?
(4)CaO+H2O===Ca(OH)2?(1分)
(5)CaO和H2O的能量和大于Ca(OH)2的能量?(2分)? (6)否 (1分)
本题解析:考查反应与能量的关系
由于生石灰溶于水放出大量的热,大试管中空气膨胀,压强增大,将导致U形玻璃管里的红墨水会沿开口端上升
该实验是否成功的关键是要保证气密性的良好
对于放热反应来讲,反应物的能量之和大于生成物的能量和
食盐溶于水的热效应不明显
本题难度:简单
4、实验题 已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,在实验室中通过下述过程可从该废水中回收硫酸铜晶体及其它物质。?
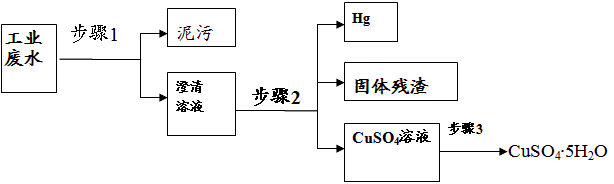
(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有___________。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)___________,生成固体残渣的的离子方程式__________。
(3)步骤3中涉及的操作是:蒸发浓缩、________、过滤、烘干。
参考答案:(1) 过滤 , 漏斗、玻璃棒 。
(2) Cu? ;Cu +2Ag+ = Cu2+ +2 Ag 。
(3) 冷却结晶
本题解析:
本题难度:一般
5、简答题 (10分)活性氧化锌用途非常广泛。以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:

已知:Zn(OH)2可溶于NaOH溶液。
请回答下列问题:
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,其目的是?。
(2)操作A所得滤渣的主要成分是?。
(3)加入过量Fe时,滤液M中与Fe反应的离子有?。
(4) 操作C所得的滤渣P中含有Fe(OH)2和Fe(OH)3,请写出生成Fe(OH)3的化学反应方程式为?。
(5)“沉淀”的成分为ZnCO3·2Zn(OH)2·H2O,可用氧化物的形式把它改写为?。
参考答案:(1)增大接触面积使其能充分反应(2分)(2)SiO2(2分)。
(3)H+、Cu2+、Fe3+(2分)。?(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(5)3ZnO·CO2·3H2O(2分)
本题解析:根据题给信息和化学工艺流程知,氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)在稀硫酸中溶解生成硫酸铜、硫酸锌、硫酸铁和硫酸亚铁,经操作A过滤,滤渣的成分为二氧化硅;向滤液M中加入过量铁,铁与硫酸铁反应生成硫酸亚铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得滤渣铁和铜的混合物,滤液N为硫酸亚铁和硫酸锌的混合物;向滤液N中加过量氢氧化钠溶液,铁元素转化为氢氧化物沉淀,过滤,滤渣P含有Fe(OH)2和Fe(OH)3,滤液Q酸化后加入碳酸钠溶液,锌元素转化为沉淀,煅烧得氧化锌。(1)“溶解”前将氧化锌粗品粉碎成细颗粒,其目的是增大接触面积使其能充分反应;(2)由上述分析知,操作A所得滤渣的主要成分是SiO2;(3)加入过量Fe时,滤液M中与Fe反应的离子有H+、Cu2+、Fe3+;(4)Fe(OH)2与氧气、水反应生成Fe(OH)3的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3; (5)“沉淀”的成分为ZnCO3·2Zn(OH)2·H2O,可用氧化物的形式把它改写为3ZnO·CO2·3H2O。2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程为载体考查物质的分离提纯、化学方程式的书写及阅读材料接受信息的能力。
本题难度:一般