微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某学生设计了如下实验:

回答下列问题:
(1)该同学的实验目的是______;
(2)上图括号内的操作步骤均为______;
(3)按此实验方案得到的NaCl固体中肯定含有______?(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______;
(4)写出生成B的离子方程式______.
2、实验题 (15分)通过测量一定质量的Fe、Al合金与M的溶液反应生成H2在标准状况下的体积,可以计算出合金中Fe、Al的旗量分数,若用下图装置来制取H2,请完成下列操作步骤直至产生H2。
 ?
?
(1)C处塞入玻璃丝绒团;
(2) A处 ___________________________
(3) B处_____________________________
(4) ____________________________________
(5) ____________________________________;
(6) 在分液櫬斗中加入M的溶液。
(7) ______________________________________________________
3、简答题 1,2,3,4-四氢化萘的结构简式如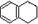 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:

①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉.
②慢慢滴入液溴,不断搅拌,直到反应完全.
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失.过滤,将滤液倒入分液漏斗,静置.
④分液,得到的“水层”即氢溴酸溶液.回答下列问题:
(1)如右图所示的装置,适合步骤①和②的操作的是______;
(2)步骤③中补充少量四氢化萘的目的是______;
(3)步骤③中过滤后得到的固体物质是______.
(4)在④获得的浓溶液中加入乙醇并加热,可获得一种不溶于水的有机物,写出该反应的方程式______;实验室制取乙炔可用上图中的装置D,这时分液漏斗中的液体通常是______.
(5)乙炔能被酸性高锰酸钾溶液氧化,请配平其相应的方程式:
______C2H2+______KMnO4+______H2SO4=______K2SO4+______MnSO4+______CO2+______H2O.
4、实验题 已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,在实验室中通过下述过程可从该废水中回收硫酸铜晶体及其它物质。?
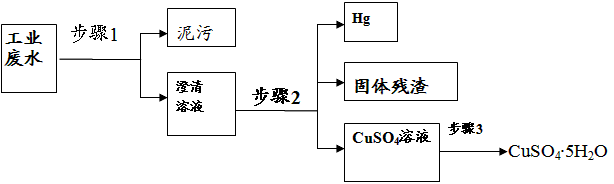
(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有___________。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)___________,生成固体残渣的的离子方程式__________。
(3)步骤3中涉及的操作是:蒸发浓缩、________、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是____________。
5、实验题 某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题:

(1)图中D装置在实验中的作用是________________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:图中试剂A为_________;试剂C为_________(填序号)。
①稀HNO3溶液?②稀盐酸?③碳酸钙?④Na2SiO3溶液?⑤SiO2?
(3)写出烧瓶中发生反应的离子方程式____________________。写出试管C中发生反应的离子方程式___________________________。由此判断,元素N、C、Si?非金属性由弱到强的顺序为___________。
(4)乙同学设计的实验所用到试剂A为________;试剂B为________;试剂C为________。 C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为______________。