微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Al和Si、Ge(锗)和As(砷)在元素周期表金属和非金属过渡位置上,且砷(As)与氮同主族,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1)As的价电子排布式为____________。
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,Al2Cl6中化学键类型是____________。
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与____个N原子相连,与同一个Al原子相连的N原子构成的空间构型为_________。在四大晶体类型中,
AlN属于____晶体。
(4)Si和C同主族,Si、C和O成键情况如下

在SiO2中,硅原子轨道杂化形式为________,1mol CO2中含有π键数目为______________。二氧化碳的熔沸点远低于二氧化硅的原因是____________。
(5)SiCl4(液)常用作烟雾剂,原因Si存在3d轨道,能同H2O(液)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理_____________________。
2、选择题 下列表达式错误的是
[? ]
A.甲烷的电子式: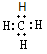 ?
?
B.氮原子的L层电子的电子排布图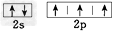 ?
?
C.硫离子的核外电子排布式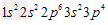 ?
?
D.碳-12原子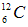 ?
?
3、简答题 试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?_____________________________________________________________________________________________________
4、填空题 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)用惰性电极电解硫酸铜溶液时,若某电解质量增加16g,则另一电极的电极方程式为___________;该电极可收集到标况下气体____________L。
(2)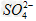 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原?子与Au原子数量之比为_______。
5、选择题 下列关于分子或晶体中中心原子的杂化类型的说法正确的是
[? ]
A.CH3CH3中的两个碳原子与BF3中的硼原子均采取sp2杂化
B.晶体硅和石英(SiO2)晶体中的硅原子均采取sp3杂化
C.BeCl2中的铍原子和H2O中的氧原子均采取sp杂化
D.CO2中的碳原子与CH2=CH2中的两个碳原子均采用sp杂化