微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度时,在2L容器中X、Y、Z三种物质随时间的
变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的 生成速率 (大、小、相等)。
参考答案:(1)3X+Y 2Z
2Z
(2)0.05 mol·(L·min)-1; 0.04 mol·(L·min)-1
(3)相等。
本题解析:(1)由“化学方程式的计量系数与反应速率(或变化量)成正比”,通过计算反应过程中的变化量之比即得到反应方程式的化学计量系数,从而得出此反应的方程式为3X+Y 2Z。
2Z。
(2)根据平均反应速率的计算公式即可解答。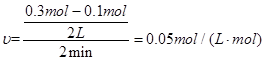
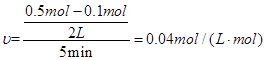
(3)5min时,反 应达到了平衡,各物质的反应速率不再改变,故5min后Z的生成速率与5min末Z的生成速率相等。
考点:化学反应速率
点评:利用反应速率的公式判断、计算反应速率的大小是高考必考知识点,考生应掌握并灵活应用。
本题难度:一般
2、选择题 已知反应A(g)+3B(g)  2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
A.1 mol/(L·s)
B.3 mol/(L·s)
C.4 tool/(L·s)
D.2 mol/(L·s)
参考答案:C
本题解析:因为反应速率之比是相应的化学计量数之比,所以根据反应的化学方程式可知,如果以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为2 mol/(L·s)×2=4 mol/(L·s),答案选C。
点评:该题是高考中的常见考点,属于常识性计算题的考查,难度不大。明确反应速率和化学计量数的关系是答题的关键,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
3、选择题 下列过程中,需要加快化学反应速率的是?(?)
A.钢铁的腐蚀
B.食物腐烂
C.工业炼钢
D.塑料老化
参考答案:C
本题解析:选项ABD应该尽可能的减缓反应速率,避免浪费。而工业炼钢应尽可能的加快反应速率,提高效率,答案选C。
点评:该题是常识性知识的考查,难度不大。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
4、选择题 已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(L?min),则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5?mol/(L?min)
B.1?mol/(L?min)
C.2?mol/(L?min)
D.3?mol/(L?min)
参考答案:对于反应A+3B=2C+D,以A的浓度变化表示的反应速率为1mol/(L?min),速率之比等于化学计量数之比,
所以1:2=1mol/(L?min):v(C),解得v(C)=2mol/(L?min),
故选C.
本题解析:
本题难度:简单
5、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)

CH3CH2OH(g)+3H2O(g)?下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
参考答案:A、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故A对;
B、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故B错;
C、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C对;
D、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D对;
故选:B.
本题解析:
本题难度:一般