微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.以上说法都不正确
参考答案:C
本题解析:
本题难度:简单
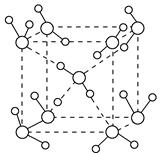
2、填空题 (1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰-Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围____________个水分子以氢键结合,晶体中,1 mol水可形成________ mol氢键。
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,___________________________。
参考答案:(1)4 2
(2)氧与氢的电负性差大于氧与氟的电负性差
本题解析:(1)观察图示的立方晶胞的中心水分子可知,该水分子与周围4个水分子以氢键结合;每2个水分子间形成的1个氢键,每个水分子只分得一半,故晶体中1 mol水可形成4 mol×0.5=2 mol氢键。(2)根据题中所给出的元素的电负性数据:H为2.1,O为3.5,F为4.0,氧与氢的电负性差(1.4)大于氧与氟的电负性差(0.5),因此,虽然OF2与水的立体结构相似,但水分子的极性比OF2强得多。
本题难度:一般
3、填空题 (10分)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的化学方程式?;
CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为?_________________________。
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是?;分子中处于同一直线上的原子数目最多为?。
(3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3, 表示阿伏加德罗常数,则立方氮化硼晶胞体积为?cm3。
表示阿伏加德罗常数,则立方氮化硼晶胞体积为?cm3。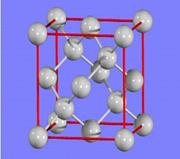
参考答案:(1)CaC2+2H2O→Ca(OH)2+C2H2↑(2分)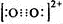 ?(2分)?
?(2分)?
(2)sp杂化?sp2杂化(2分)? 3(1分)?(3)100/aNA?(3分)
本题解析:(1)考查乙炔的实验室制取。C22-含有14个电子,所以O22+的电子式可表示为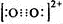 。
。
(2)丙烯腈分子中含有碳碳双键和碳碳三键,所以碳碳三键的碳原子是sp杂化,碳碳双键的碳原子是sp2杂化。由于碳碳三键是直线型结构,而碳碳双键是直线型结构,所以分子中处于同一直线上的原子数目最多为3个。
(3)结构与金刚石相似,所以晶胞中含有的氮原子和硼原子的个数都是4个,所以该晶胞的质量是4×25/NA,因此体积是100/aNA。
本题难度:简单
4、选择题 下列说法中,正确的一组是
①两种元素组成的共价化合物的分子中的化学键都是极性键
②两种不同非金属元素的原子之间形成的化学键都是极 性键
性键
③分子晶体中相对分子质量越大则熔沸点越高
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤离子化合物中一定含有离子键
⑥分子内可能没有共价键
⑦共价化合物形成的晶体一定是分子晶体
⑧原子晶体中一定有非极性共价键
A.只有②⑤⑥⑦
B.只有②⑤⑥
C.只有①②③⑤⑥⑧
D.只有②③⑤⑥⑦
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
参考答案:C
本题解析:晶体熔沸点高低比较的一般规律是:原子晶体,熔沸点大小和共价键的强弱有关系;金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高;分子晶体中形成分子晶体的分子间作用力越大,熔沸点越高;离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高。A中都是分子晶体,B中都是原子晶体,D中都是离子晶体,其熔点大小顺序是正确的;C中是金属晶体,熔点等闲视之应该是Na<Mg<Al,答案选C。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力。该题的关键是明确晶体熔点大小比较的规律,然后结合题意灵活运用即可。
本题难度:简单