微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以食盐为原料进行生产并综合利用的某些过程如下图所示。
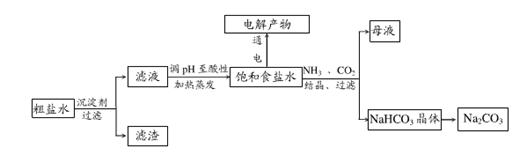
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)_____。
A.Na2CO3 B.NaOH C.BaCl2
(2)将滤液的pH调至酸性除去的离子是________。
(3)下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是________,在X极附近观察到的现象是________,电解NaCl溶液的离子方程式是_________。

(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是________。
参考答案:(1)C、B、A(或B、C、A);(2)CO32-和OH-;(3)2H++2e-=H2↑有无色气泡产生,溶液变红;2Cl-+2H2O Cl2↑+H2↑+2OH-(4)NH3
Cl2↑+H2↑+2OH-(4)NH3
本题解析:(1)首先向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,然后向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;最后加入Na2CO3 ,发生反应Ca2++ CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是B、C、A。也可以是首先向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;然后向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,最后加入Na2CO3发生反应Ca2++CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是C、B、A。
(2)过滤后溶液中含有过量的NaOH、Na2CO3。这时向溶液中加入盐酸,发生反应:H++ OH-= H2O; CO32-+2H+=CO2↑+H2O;因此将滤液的pH调至酸性除去的离子是CO32-和OH-。
(3)在电极食盐水的装置中,与电源正极相连的Y电极为阳极,由于阴离子Cl-、OH-的放电能力Cl->OH-。所以在电极Y上发生的反应为:2Cl—--2e-=Cl2↑; 与电源负极相连的X电极为阴极,由于阳离子H+、Na+的放电能力H+>Na+。所以在电极X上发生的反应为:2H++2e-=H2↑;由于H+不断放电消耗,破坏了附近的水的电离平衡,水会继续电离直至达到新的平衡状态,最终导致附近的溶液中C(OH-)>C(H+),因此滴入几滴酚酞溶液后,在X电极附近溶液变为红色。电解NaCl溶液的离子方程式是2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(4)发生反应后的母液中含有大量的NH4Cl,若向分离出NaHCO3晶体后的母液中加入过量生石灰,会发生反应CaO+ H2O= Ca(OH)2,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
考点:考查粗盐中杂质的除去的方法、步骤及电解食盐水的反应原理、现象和物质的综合利用的知识。
本题难度:一般
2、选择题 某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是

[? ]
A.K与M、N均断开,一段时间后电解质溶液质量变大
B.K分别与M、N相连时,铁均受到保护
C.K与M相连时,每转移1mol电子Fe表面生成32gCu
D.K与N相连时,?碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
参考答案:D
本题解析:
本题难度:一般
3、填空题 (12分)北京2008年奥运会金牌直径为70 mm,厚6 mm。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场。奖牌背面镶嵌着取自中国古代龙纹玉璧造型的玉璧。
(1)环形玉璧由白玉制成。白玉的化学成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式为________________。
(2)为测定金牌的组成,将某去掉白玉的金牌样品,投入到过量稀硝酸中,有无色气体产生,当不再生成气体时,金牌残留一金黄色外壳;将生成的气体与11.2 L O2(标准状况)混合即呈红棕色,最后将其通入水中,所有气体完全被水吸收生成硝酸;再向金牌溶解所得的溶液中滴加氯化钠,立即产生白色沉淀;最后将残壳投入到王水中,随即溶解,生成气体的体积为1.344 L( 标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
①该金牌所含黄金质量为________。
②该金牌除含黄金外还含有另一金属是________(填元素符号),其质量为________。
(3)黄金除能溶于王水外还能溶于氰化钾,反应方程式如下:
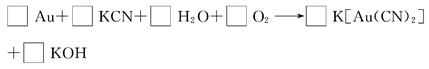
①配平该反应,并将计量数填入方框内。
②K[Au(CN)2]可作为电镀金的电镀液,金牌表面的黄金就是通过电镀镀上的。在电镀金牌时,阴极反应式为________________________________。
参考答案:
(1)2CaO·5MgO·8SiO2·H2O
(2)①11.82 g ②Ag 216 g
(3)①4 8 2 1 4 4
②[Au(CN)2]-+e-―→Au+2CN-
本题解析:略
本题难度:简单
4、选择题 金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+)
[? ]
A.阳极发生还原反应,其电极反应式为:Ni2++2e-→Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
参考答案:D
本题解析:
本题难度:一般
5、选择题 高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是?

A铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C若隔膜为阴离子交换膜,则OH-自右向左移动
D电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
参考答案:D
本题解析:铁是阳极,溶液呈碱性,不可能生成H+,A错;电解时电子的流动方向是,负极→Ni电极,溶液中是离子导电,再者是Fe→正极,B错;因阳极消耗OH-,所以OH-通过阴离子交换膜自左向右移动,C错;电解时阳极消耗OH-而使附近的pH降低,阴极周围因生成OH-向右侧移动而pH升高,因总反应的消耗OH-,撤去隔膜混合后,与原溶液比较pH降低,D正确。
本题难度:一般