微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 影响化学反应速率的因素有多方面,如浓度、压强、温度、催化剂等。下列有关说法不正确的是
[? ]
A.增大压强不一定能加快反应速率
B.增大浓度能增加反应体系中活化分子的百分数
C.升高温度能增加反应物分子之间的有效碰撞次数
D.催化剂能改变反应的活化能
参考答案:B
本题解析:
本题难度:一般
2、实验题 控制变量法是化学实验中的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
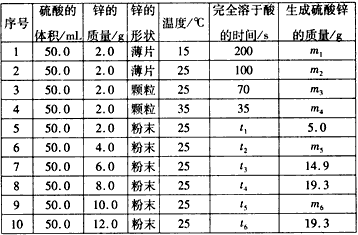
分析上表数据,回答下列问题:
(1)实验1和实验2表明__________ 对反应速率有影响,对这一规律进行研究的实验还有一组是________(填实验序号)。
(2)下列数据推断正确的是_________。
A.t1<70
B.ml< m2
C.m6=19. 3
D.t1>t4
(3)本实验还可以研究____________对化学反应速率的影响。
(4)硫酸的物质的量浓度是____mol/L,实验6生成的硫酸锌的质量m5=_________。
参考答案:(1)温度;3和4
(2) AC
(3)硫酸的浓度和催化剂(或压强)
(4)2.4;9.9
本题解析:
本题难度:一般
3、选择题 下列不同条件下的化学反应A+B=C+D,反应速率按由大到小的顺序排列,正确的一组是
[? ]
①常温下20 mL含A和B各0.001 mol
②常温下100 mL含A和B各0.01 mol
③常温下0.05 mol/L的A,B溶液各10 mL,再加入蒸馏水20 mL
④常温下100 mL含A 0.01 mol和20 mL 含B 0.001 mol
A.①②③④
B.④③②①
C.②④①③
D.②①④③
参考答案:C
本题解析:
本题难度:一般
4、实验题 (8分)某化学反应2A (g)  ?B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:
?B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:
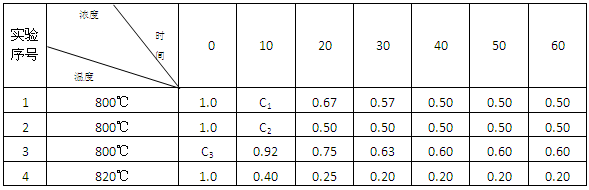
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是?min,实验4达到平衡的时间是?min.
(2)C1?C2(填“大于”“小于” “等于”);C3= ?mol?L-1
(3)实验4比实验1的反应速率?(填“快”或“慢”),原因是?
(4)如果2A (g)  ?B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,??放出的热量多,理由是?。
?B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,??放出的热量多,理由是?。
参考答案:(1)40? 30?(2)大?大于1.0
(3)?快?实验4的温度比实验1高,温度越高,反应越快
(4)实验1?升高温度平衡向逆方向移动
本题解析:(1)当反应达到平衡状态后,各种物质的浓度和含量将不再发生变化。根据表中数据可知实验1和实验4在分别反应进行到40min和30min时A的浓度就不再随时间变化而变化,这说明反应已经达到化学平衡状态。
(2)实验1和实验2相比温度相同,起始浓度相同,到达平衡时A的浓度也相同,但到达平衡的时间是实验2用时少,这说明实验2的反应速率大,进行的快,因此1.0-C1<1.0-C2,所以C1>C2。因为随着反应的进行,A的浓度逐渐减小,所以反应速率会逐渐减小,即C3-0.92mol/L>0.92mol/L-0.75mol/lL,所以C2>1.0mol/L。
(3)实验4的温度要高于实验1的温度,所以反应快。
(4)反应放热,则升高温度平衡向逆反应方向移动,A的转化率降低,所以放出的热量少。
本题难度:一般
5、填空题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值)
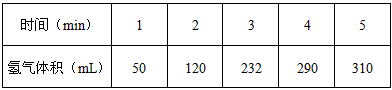
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大____________,原因是____________________________________。
(2)哪一段时段的反应速率最小____________,原因是________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)
________________________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)____________。
参考答案:(1)2~3min;因该反应是放热反应,2~3min时温度高
(2)4~5min;因为4~5min时H+浓度小
(3)0.1mol/(L·min)
(4)AB
本题解析:
本题难度:一般