微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应4A(s)+2B(g)?3C(g),下列说法正确的是( )
A.体积不变充入惰性气体,反应速率增大
B.其他条件不变,降低温度,反应速率减慢
C.其他条件不变时,增大压强,活化分子百分数增大,化学反应速率加快
D.若增加或减少A物质的量,反应速率一定会发生明显的变化
2、选择题 从下列实验事实所引起的相应结论不正确的是( )
| 选项 | 实? 验? 事? 实 | 结? 论
?
A
其它条件不变,0.01mol/L的KMnO4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短.
当其它条件不变时,增大反应物浓度可以使化学反应速率加快
?
B
其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊.
当其它条件不变时,反应体系的温度越高、化学反应速率越快
?
C
将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变.
催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程
?
D
一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)?2HI(g),获得等量HI时需要的时间前者少.
当其它条件不变时,气态反应体系的压强越大、化学反应速率越快
|
A.A
B.B
C.C
D.D
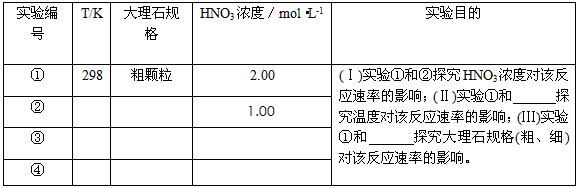
3、实验题 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
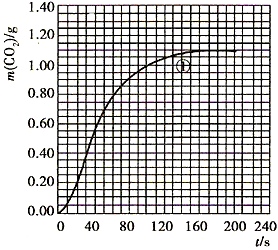
(2)实验①中CO2质量随时间变化的关系见下图
依据反应方程式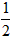 CaCO3+HNO3==
CaCO3+HNO3== Ca(NO3)2+
Ca(NO3)2+ CO2↑+
CO2↑+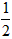 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
4、选择题 将a mol PCl5充入一个真空密闭容器中,加热到200 ℃,发生如下反应:PCl5(g) PCl3(g)+Cl2(g),达到平衡时,PCl5所占体积分数为M%。这时再向容器中充入a mol PCl5,同温同压下达到平衡,此时PCl5体积分数为N%,则M与N的关系为(?)
PCl3(g)+Cl2(g),达到平衡时,PCl5所占体积分数为M%。这时再向容器中充入a mol PCl5,同温同压下达到平衡,此时PCl5体积分数为N%,则M与N的关系为(?)
A.M>N
B.M<N
C.M="N"
D.不能确定
5、选择题 下列说法不正确的是
[? ]
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大