微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
参考答案:(1)正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12
(2)a-2<b<a
(3)浅 能 0.010 mol·L-1氨水(滴有酚酞试液)中加入氯化铵晶体后颜色变浅,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均可证明NH3·H2O是弱电解质
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均可证明NH3·H2O是弱电解质
(4)取一张pH试纸,再用玻璃棒蘸取0.1 mol·L-1 NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7(方案合理即可)
本题解析:(1)若NH3·H2O是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12。用pH试纸测出0.010 mol·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质。
(2)若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,不能完全电离,a、b应满足a-2<b<a。
(3)向0.010 mol·L-1氨水中加入少量NH4Cl晶体,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
(4)NH4Cl为强酸弱碱盐,只需检验NH4Cl溶液的酸碱性,即可证明NH3·H2O是弱电解质,还是强电解质。
本题难度:一般
2、填空题 (10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN? B.? HClO? C.? CH3COOH? D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________?______?。
②几种离子开始沉淀时的pH如下表:
离子
| Fe2+
| Cu2+
| Mg2+
|
pH
| 7.6
| 5.2
| 10.4
|
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,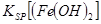 _________
_________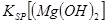 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
参考答案:1)CO32- (2分)? C (2分)?
(2)①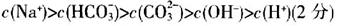
② Cu2+ (2分)? < (2分)
本题解析:(1)五种钠盐都属于强碱弱酸盐,越弱越水解,且水解后的溶液碱性越强,水解程度越大,故Na2CO3水解程度最大,即CO32-结合H+能力最强。由表知道,CH3COOH最弱,故越弱越电离,稀释后,最弱的pH变化最大。
(2)①0.3mol的NaOH溶液吸收标准状况下4.48LCO2时,CO2过量,故生成物为NaHCO3,在溶液中,存在着HCO3-的电离和水解反应,且水解大于电离
点评:此题考核了弱电解质的电离和水解,要记得弱酸根或弱碱根是越弱越水解,弱酸盐和弱碱盐是越弱越电离。
本题难度:简单
3、填空题 现有室温的①HCl、②H2SO4、③CH3COOH三种溶液.
(1)若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是______(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是______.
(2)若三种酸均为0.1mol?L-1的溶液,它们的pH由大到小的顺序是______,完全中和物质的量均相同的三份NaOH溶液时,需三种酸的体积大小关系是______.
参考答案:(1)盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,三种酸中C(HCl)=C(H+),2C(H2SO4)=C(H+),C(CH3COOH)>C(H+),所以要使氢离子浓度相等,则三种酸的物质的量浓度大小顺序是③>①>②;三种酸溶液各取1mL,分别加水到1000mL,盐酸和硫酸溶液中氢离子浓度是原来的11000,醋酸中存在电离平衡,加水稀释促进醋酸电离,则醋酸溶液中氢离子浓度大于原来的11000,所以稀释后氢离子浓度最大的是醋酸,
故答案为:③>①>②;③;
(2)三种酸均为0.1mol?L-1的溶液,三种酸中C(HCl)=C(H+),2C(H2SO4)=C(H+),C(CH3COOH)>C(H+),所以离子浓度最大的是硫酸,其次是盐酸,醋酸溶液中氢离子浓度最小,它们的pH由大到小的顺序是③>①>②; 三种酸的浓度相等,盐酸和醋酸都是一元酸,硫酸是二元酸,硫酸溶液中氢离子浓度是盐酸溶液中的2倍,则完全中和物质的量均相同的三份NaOH溶液时,盐酸和醋酸需要的体积相等,需要硫酸的体积是盐酸的2倍,所以需三种酸的体积大小关系是①=③>②,
故答案为:③>①>②; ①=③>②.
本题解析:
本题难度:一般
4、选择题 甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3·H2O、Na2CO3中的一种。常温下如下实验:①将0.1 L pH=9的甲溶液分别与a L 0.001 mol/L的乙溶
液、b L 0.001 mol/L的丁溶液充分反应后溶液呈中性时,a>b;②浓度均为0.1 mol/L
的丙和丁溶液等体积混合后,溶液呈酸性;③0.1 mol/L的甲溶液pH小于0.1 mol/L
的戊溶液pH。下列判断正确的是
A.甲的溶质是NH3·H2O
B.乙的溶质是CH3COOH
C.丙的溶质是NaOH
D.戊的溶质是HCl