微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在2H2S+SO2=2H2O+3S中,氧化剂与还原剂的分子个数比为
A.2:1
B.1:2
C.1:1
D.16:17
参考答案:B
本题解析:分析:由反应2H2S+SO2═3S+2H2O可知,H2S中S元素化合价由-2价升高为0价,H2S是还原剂,SO2中S元素化合价由+4价降低为0价,SO2是氧化剂.根据反应中化合价发生变化的S原子数目结合N=nNA计算判断氧化剂和还原剂的分子个数比.
解答:反应2H2S+SO2═3S+2H2O中,H2S中S元素化合价由-2价升高为0价,H2S是还原剂;SO2中S元素化合价由+4价降低为0价,SO2是氧化剂.根据反应中化合价发生变化的S原子数目可知参加反应的H2S全部为还原剂,参加反应的SO2全部为还原剂,所以氧化剂与还原剂的物质的量之比等于化学计量数之比为1:2,根据N=nNA知,氧化剂和还原剂的分子个数之比等于其物质的量之比=1:2,故选B.
点评:考查氧化还原反应的计算、氧化还原反应基本概念,难度不大,关键根据化合价判断氧化剂与还原剂.
本题难度:一般
2、选择题 室温下,下列各组离子在指定溶液中可能能大量共存的是
A.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+
B.c(H+)=1.0×10-13mol/L溶液中:CO32-、K+、SO42-、Br-
C.Na2S溶液中:SO42-、K+、Cl-、Cu2+
D.pH=12的溶液中:NO3-、I-、Na+、Al3+
参考答案:B
本题解析:分析:A.离子之间结合生成沉淀;
B.c(H+)=1.0×10-13mol/L溶液,为酸或碱溶液;
C.离子之间结合生成沉淀;
D.pH=12的溶液,显碱性,离子之间结合生成沉淀.
解答:A.AlO2-、H+离子之间结合生成沉淀,若酸过量生成铝离子,则一定不能共存,故A错误;
B.c(H+)=1.0×10-13mol/L溶液,为酸或碱溶液,若为碱溶液,该组离子之间不反应,则可能共存,故B正确;
C.S2-、Cu2+离子之间结合生成沉淀,则不能共存,故C错误;
D.pH=12的溶液,显碱性,Al3+、OH-离子之间结合生成沉淀,若碱过量生成AlO2-,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确信息及离子之间的反应即可解答,注意物质的溶解性及结合生成沉淀的离子反应,题目难度不大.
本题难度:简单
3、选择题 在下列溶液中,各组离子一定能够大量共存的是
A.某强酸性溶液:Na+、Fe2+、Cl-、ClO-
B.常温下,=1012的溶液:K+、Ba2+、Cl-、NO3-
C.常温下,pH=14的溶液:Al3+、Na+、Cl-、HCO3-
D.加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、CO32-
参考答案:B
本题解析:分析:A.离子之间发生氧化还原反应;
B.常温下,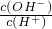 =1012的溶液,c(OH-)=0.1mol/L,溶液显碱性;
=1012的溶液,c(OH-)=0.1mol/L,溶液显碱性;
C.常温下,pH=14的溶液,显碱性;
D.加入铝粉能放出大量H2的溶液,为酸或强碱溶液.
解答:A.强酸性溶液中Fe2+、ClO-发生氧化还原反应,则不能共存,故A错误;
B.常温下,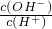 =1012的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间不反应,则能共存,故B正确;
=1012的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间不反应,则能共存,故B正确;
C.常温下,pH=14的溶液,显碱性,OH-分别与Al3+、HCO3-反应,且HCO3-、Al3+相互促进水解,则一定不能共存,故C错误;
D.加入铝粉能放出大量H2的溶液,为酸或强碱溶液,酸溶液中氢离子与CO32-反应,碱溶液中OH-与NH4+反应,则一定不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确题目中的信息及常见离子之间的反应即可解答,注意发生的氧化还原反应、相互促进水解反应为解答的难点,题目难度不大
本题难度:简单
4、选择题 据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6).已知O2(PtF6)?为离子化合物,其中Pt为+5价.对于此反应,下列说法正确的是
A.此反应 是非氧化还原反应
B.O2(PtF6)?中氧元素的化合价是+1价
C.在此反应中,O2是还原剂,PtF6是氧化剂
D.此反应中,每生成1mol?O2(PtF6)转移1mol?电子
参考答案:CD
本题解析:分析:O2(PtF6)?为离子化合物,其中Pt为+5价,则O2为+1价,在反应O2+PtF6→O2(PtF6)中,O2是还原剂,PtF6是氧化剂,结合化合价的变化判断转移电子的数目.
解答:A.反应中O和Pt元素的化合价发生变化,属于氧化还原反应,故A错误;
B.根据化合价代数和为0可知,O2(PtF6)?为离子化合物,其中Pt为+5价,则O2为+1价,氧元素的化合价是+0.5价,故B错误;
C.在此反应中,O元素化合价升高,O2是还原剂,PtF6中Pt元素化合价降低,为氧化剂,故C正确;
D.此反应中,O元素化合价升高0.5价,则每生成1mol?O2(PtF6)转移1mol?电子,故D正确.
故选CD.
点评:本题考查氧化还原反应,题目难度不大,注意正确判断元素的化合价的变化为解答该题的关键.
本题难度:困难
5、选择题 下列各组离子在指定溶液中可能大量共存的离子是
A.在强酸性溶液中:Mg2+、F-、Ba2+、NO3-
B.在pH=6的溶液中:K+、NO3-、Fe3+、Cl-
C.在NH4Cl溶液中:Ba2+、Na+、AlO2-、NO3-
D.使甲基橙变红的溶液中:Na+、NO3-、Al3+、SO42-
参考答案:D
本题解析:分析:A.F-与H+反应;
B.pH=6的溶液呈弱酸性,Fe3+不能大量存在;
C.NH4Cl溶液呈酸性;
D.使甲基橙变红的溶液呈酸性.
解答:A.强酸性溶液中F-与H+反应生成弱电解质,不能大量共存,故A错误;
B.Fe3+在pH约约为3.7时完全水解,则pH=6的溶液呈弱酸性,Fe3+不能大量存在,故B错误;
C.NH4+与AlO2-发生互促水解而不能大量共存,故C错误;
D.使甲基橙变红的溶液呈酸性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,综合考查元素化合物知识,侧重于考查学生化学知识的综合运用,易错点为B,注意铁离子水解的性质,题目难度不大.
本题难度:困难