微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定温度和压强下,有如下反应:2SO2(g)+O2(g)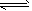 2SO3(g),将1.6mol SO2和0.8mol O2放入一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
2SO3(g),将1.6mol SO2和0.8mol O2放入一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
(1)达平衡时混合气体的体积为______________L,SO2的转化率为______________。
(2)若起始时加入a mol SO2、b mol O2,且a:b=2:1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
(3)若容器为体积不变的密闭容器,其容积为100L。起始时加入xmol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为______________,x、z应该满足的关系式为______________。
参考答案:(1)80L;60%
(2)2.4;1.2
(3)x:y=2:1;x+z=2
本题解析:
本题难度:一般
2、选择题 有关合成氨的下列叙述中,不能用勒夏特列原理解释的是
A.加入催化剂能使合成氨反应速率加快
B.高压有利于提高NH3的产量
C.温度过高不利于氨的生成
D.增大N2浓度能提高H2的转化率
参考答案:A
本题解析:加入催化剂只能加快化学反应速率,而不能使化学平衡移动,所以正确选项为A;
本题难度:一般
3、填空题 .(10分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g),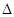 H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是? __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是? __
A.增加B的物质的量? B.加压? C.升温? D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。

则图中表示醋酸溶液中pH变化曲线的是?(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?m2(选填<﹑=﹑>)
参考答案:(1)AC(每个1分)?(2)< ;=?(3)B; <
本题解析:(1)反应是条件增大、吸热发热可逆反应,所以要增大A的转化率,平衡应该向正反应方向移动,所以选项AC均可以。加压平衡向逆反应方向移动。催化剂不能改变平衡状态。所以正确的答案是AC。
(2)若恰好反应,则生成物醋酸钠水解显碱性,因此要显中性,醋酸一定是过量的。即氢氧化钠的浓度小于醋酸的。
(3)醋酸是弱电解质,存在电离平衡。在反应过程中会继续电离出氢离子,所以醋酸中氢离子的浓度变化程度小于盐酸。因此要使反应后的pH相等,则醋酸需要的时间就多,即B表示醋酸的。醋酸中消耗的氢离子多,则相应的锌消耗的也就多。
本题难度:一般
4、填空题 (1)(4分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)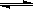 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:

①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)(3分)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)(3分)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为??。
(4)(3分)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)=?mol·L-1。
参考答案:(16分)
(1)(4分)<? 60%
(2)(3分)M++H2O MOH+H+
MOH+H+
(3)(3分)1:10:100:1
(4)(3分)6×10-3
(5)(3分)7
本题解析::(1)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0。②令平衡时CO的物质的量变化为nmol,则:
1/3Fe2O3(s)+CO(g)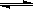 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
开始(mol):1 ?1
变化(mol):n ?n
平衡(mol):1-n? 1+n
所以(1+n)/(1-n) =4,解得n=0.6,
所以n(CO)=0.6mol÷1mol×100%=60%。
(2)依据盐类的规律“谁弱谁水解,谁强显谁性”,MR是弱酸强碱盐,故水解反应的离子方程式为M++H2O MOH+H+。
MOH+H+。
(3)四种溶液中由水电离产生的c(H+)分别为:10-14、10-13、10-12、10-14,之比为1:10:100:1。
(4)电离常数Ka(HF)=c(H+)×c(F-)÷c(HF) =3.6×10-4,c(HF)=" 0.1" mol·L-1,c(H+)=c(F-),故c(H+)=6×10-3。
(5)(3分)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L。在此温度下5×10—5mol/LBa(OH)2溶液的pH=?。
(5)在温度t ℃时,离子积常数K= c(OH-)×c(H+)=10-3 (mol/L)×10-8 (mol/L) =10-11 (mol/L)2。5×10—5mol/LBa(OH)2溶液中,c(OH-)=10-4 mol/L,根据K= c(OH-)×c(H+),得c(H+)= 10-7 mol/L,pH=7。
点评:本题考查的是综合的知识,题目难度中,注意基础知识的学习、掌握及应用。
本题难度:一般
5、选择题 下列说法不正确的是
A.能够发生化学反应的碰撞是有效碰撞
B.正反应进行的程度大、正反应速率一定大
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.化学平衡发生移动时、化学反应速率一定变化
参考答案:B
本题解析:A正确,有效碰撞是指能够发生化学反应的碰撞;B错,正反应进行的程度大、正反应速率不一定大,如移走生成物,平衡向正反应方向移动,但正反应速率减小;C正确,反应物的总能量高于生成物的总能量时,发生放热反应,反之为吸热反应;D正确,平衡是指正、逆反应速率相等,若平衡移动即正、逆反应速率一定不等会变化;
本题难度:一般