微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 明矾的化学式为KAl(SO4)2·12H2O,向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是?
[? ]
A.部分为Al(OH)3沉淀,部分以Al3+形式存在
B.全部为Al(OH)3沉淀
C.部分为Al(OH)3,部分为[Al(OH)4]-
D.全部以[Al(OH)4]-形式存在
参考答案:D
本题解析:
本题难度:简单
2、简答题 实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下
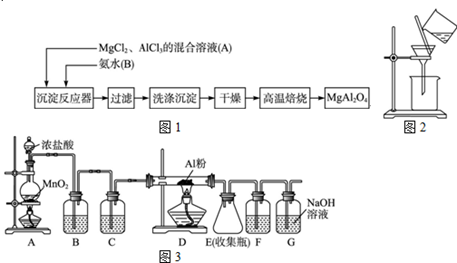
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入??(填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式?。
(2)如下图所示,过滤操作中的一处错误是??。
(3)判断流程中沉淀是否洗净所用的试剂是??,高温焙烧时,用于盛放固体的仪器名称是??。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是?,F中试剂的作用是??。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为??;
参考答案:(1)B? Mg(OH)2+2Al(OH)3 ?MgAl2O4+4H2O
?MgAl2O4+4H2O
(2)漏斗下端尖嘴未紧贴烧杯内壁
(3性的AgNO3溶液)?坩埚
(4)除去HCl;吸收水蒸气;碱石灰
本题解析:(1)如先加入MgCl2、AlCl3的混合溶液,再加氨水,氨水少量,应先生成氢氧化镁沉淀,反之,先加氨水,因氨水足量,则同时生成沉淀。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式是,Mg(OH)2+2Al(OH)3 MgAl2O4+4H2O。
MgAl2O4+4H2O。
(2)过滤时应该将漏斗的尖嘴部分紧贴烧杯的内壁,防止液体溅出。
(3)沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸性的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净,高温焙烧固体应在坩埚中进行。
(4)B中的饱和食盐水是为了除去混有的HCl气体;因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰来代替F和G的作用。
本题难度:一般
3、选择题 有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1 AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是
A.现象相同,沉淀量相等
B.现象不同,沉淀量不等
C.现象相同,沉淀量不等
D.现象不同,沉淀量相等
参考答案:D
本题解析:①现象为先沉淀后沉淀溶解;②现象为先无沉淀后有沉淀生成。因反应物给的量是相等了,故沉淀量是相等的。故选D。
点评:本题考查的是无机反应的知识和化学计算,AlCl3溶液分和NaOH溶反应,分析清楚滴加顺序不同反应就不同的原理是解题的关键,题目难度适中。
本题难度:一般
4、填空题 (9分)胃舒平主要成分是氢氧化铝,同时含有三硅镁(Mg2Si3O?8`H2O)等化合物。
(1)比较铝离子和镁离子半径大小(用离子符号表示)______________________。
(2)比较铝和镁的第一电离能大小__________________(用元素符号表示)
(3)下列事实不能说明镁比铝的金属性强的是____________
A.Al(OH)3可溶于强碱溶液中,M g(OH)2不能
g(OH)2不能
B.Mg能从铝盐溶液中置换出铝
C.Mg 原子最外层只有2个电子, 而Al原子最外层有3个电子
D.Mg与盐酸反应比铝与盐酸反应更剧烈
 点,都可以制耐火材料,其原因是_____________________
点,都可以制耐火材料,其原因是_____________________