微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学知识在生产和生活中有着重要的应用,下列说法中不正确的是
A.明矾常做净水剂
B.与铜质水龙头连接处的钢质水管易发生腐蚀
C.发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔
D.金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火
参考答案:D
本题解析:A、明矾中的铝离子水解生成的氢氧化铝胶体具有较大的吸附面积,可以吸附水中的杂质,起到净水作用,正确;B、铁比铜活泼,所以铜质水龙头连接处的钢质水管易发生腐蚀,正确;C、发酵粉中的NaHCO3与产生的酸反应,生成二氧化碳气体,使焙制出的糕点疏松多孔,正确;D、金属钠着火时产生过氧化钠与泡沫灭火器中的二氧化碳反应生成氧气,使火势更旺,错误,答案选D。
本题难度:简单
2、填空题 磷酸镁铵(NH4MgPO4)是一种重要的盐,难溶于水。化学上制备磷酸镁铵从反应原理看,是用氯化镁、磷酸氢二钠和氨水混合反应的方法。
(1)写出制备磷酸镁铵反应的离子方程式:_______________________________。
(2)在实际制备的反应中,要向混合液中加入适量的铵盐(NH+4),则加入铵盐的目的是___________________________________。
参考答案:(1)Mg2++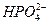 +NH3·H2O====NH4MgPO4↓+H2O
+NH3·H2O====NH4MgPO4↓+H2O
(2)抑制NH3·H2O的电离,防止生成Mg(OH)2
本题解析:第(2)题应从得到的沉淀是否纯净来考虑,因为氨水电离出的OH-能与Mg2+反应生成Mg(OH)2沉淀致使得到的磷酸镁铵不纯,加铵盐可抑制NH3·H2O电离,防止产生Mg(OH)2沉淀。
本题难度:简单
3、填空题 某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤
| 实验现象
|
①将打磨过的铝片(过量)放入一定浓度的CuCl?2溶液中。
| 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。
|
②反应结束后分离出溶液备用。
| ?
|
③红色固体用蒸馏水洗涤后,置于潮湿空气中。
| 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。
|
?
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体?;
③一段时间后固体由红色变为绿色?。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是?。
解释此现象的离子方程式是?、?。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
?。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是?。
参考答案:(1)①2Al+3Cu2+=2Al3++3Cu?③2Cu+O2+H2O+CO2=Cu2(OH)2CO3
(2)白色沉淀生成,后沉淀逐渐溶解至消失? Al3++3OH-=Al(OH)3↓? Al(OH)3+OH-=AlO2-+2H2O
(3)①3MnO2+4Al 3Mn+2Al2O3?②MnO2+H2O2+2H+=Mn2++O2↑+2H2O
3Mn+2Al2O3?②MnO2+H2O2+2H+=Mn2++O2↑+2H2O
本题解析:(1)①置换反应就是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,该反应为置换反应,所以本题答案为:2Al+3CuCl2=3Cu+2AlCl3;
③化合反应就是由两种或两种以上的物质生成一种其他物质的化学反应,红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为化合反应,所以本题答案为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3
(2)用石墨作电极,电解AlCl3溶液,电极反应式阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,破坏了H2O的电离平衡,使溶液呈碱性,Al3++3OH-=Al(OH)3↓,持续电解,Al(OH)3又溶于过量的碱,Al(OH)3+OH-=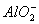 +2H2O。
+2H2O。
(4)铝与MnO2发生铝热反应,4Al+3MnO2 2Al2O3+3Mn。在酸性条件下MnO2具有氧化性,把H2O2氧化成O2,MnO2变成Mn2+。MnO2+H2O2+2H+=Mn2++2H2O+O2↑
2Al2O3+3Mn。在酸性条件下MnO2具有氧化性,把H2O2氧化成O2,MnO2变成Mn2+。MnO2+H2O2+2H+=Mn2++2H2O+O2↑
本题难度:一般
4、选择题 一种新型镁铝合金的化学式为Mg17Al12,它具有储氢性能,该合金在一定条件下完全吸氢的化学方程式为:Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)在一定条件下能释放出氢气。下列说法正确的是
A.该合金的熔点介于金属镁和金属铝熔点之间
B.该合金中镁元素呈负价,铝元素呈正价
C.制备该合金应在氮气保护下,将一定比例的Mg、Al单质在一定温度下熔炼而获得
D.1mol Mg17Al12完全吸氢后得到的混合物Y与盐酸完全反应释放出H2,若消耗盐酸的体积为14L,则该盐酸的物质的量浓度为5mol.L-1
参考答案:C
本题解析:合金是指将两种或两种以上的金属(或金属跟非金属)熔合在一起而形成的具有金属特性的物质。A、合金的特性之一就是熔点比成分金属的低,错误;B、合金就是金属的混合,都为零价,错误;C、氮气与镁要发生反应,错误;D、1mol Mg17Al12完全相当于是17mol Mg与12mol Al混合。正确。
本题难度:一般
5、选择题 要从Al2(SO4)3溶液中制得Al(OH)3,最好的方法是
A.加人NaOH溶液
B.加人氨水
C.加人Ba(OH)2溶液
D.加人Ca(OH)2溶液
参考答案:B
本题解析:
正确答案B
A、NaOH过量后Al (OH)3溶解;Al3++3NH3·H2O=Al(OH)3+3NH4+C、有BaSO4沉淀;D、有CaSO4沉淀。
本题难度:一般