微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是?(?)
A.氢氧化钠溶液
B.稀硫酸
C.盐酸
D.稀硝酸
参考答案:A
本题解析:首先铝与硝酸反应不放氢气,D错误,铝与剩余三种物质均可产生氢气。铝质量一定,当三种物质足量时,产生氢气的量相同,根据与三种物质反应后的产物的化学式(分别是NaAlO2、Al2(SO4)3、AlCl3)来判断,所用氢氧化钠物质的量最少,答案选A。
本题难度:一般
2、选择题 在①Al?②Al(OH)3?③H2SO4?④?NaHCO3?⑤Na2CO3中,与盐酸和氢氧化钠溶液均可反应的是?
[? ]
A.①②④?
B.①③⑤?
C.①②③④?
D.②④⑤
参考答案:A
本题解析:
本题难度:简单
3、计算题 (8)将一定质量的Mg和Al混合物投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体 积关系;如图所示。计算:
积关系;如图所示。计算:
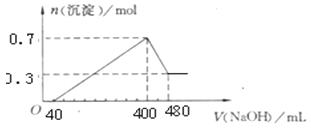
(1)Mg和Al的总质量为多少g?
(2)硫酸的物质的量浓度为多少?
(3)生成的H2物质的量为多少?
参考答案:(第一问2分,第二问3分,第三问3分共8分)
(1)18?g?(1)2.5?mol/l? (3)? 0.9mol
本题解析:略
本题难度:一般
4、填空题 (21分)有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O?②B→A + H2O?③C+ NaOH→B+NaCl?④E+ H2O→NaOH+F
+ H2O?③C+ NaOH→B+NaCl?④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A?,B?,C?,E? ?。
?。
⑵写出①③④的离子方程式:
①?,?
③?,
④?。
参考答案:略
本题解析:略
本题难度:一般
5、填空题 (12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验:
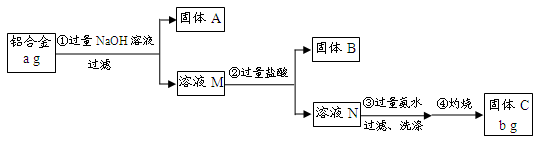
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是?;
(2)生成固体B的离子方程式为?;
步骤③中生成沉淀的离子方程式为?;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为?
?;
(4)该样品中铝的质量分数是?;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是?;
A.第①步中加入NaOH溶液不足
B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤
D.第④步对沉淀灼烧不充分
参考答案:(1)Mg、Cu?
(2)SiO32-+2H+=H2SiO3↓?Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+ ?
(3)取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净。?
(4)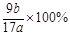 ?(5)C D? (每空2分)
?(5)C D? (每空2分)
本题解析:⑴根据铝合金的主要成分为铝、镁、铜、硅,只有铝、硅与过量NaOH溶液反应溶解,则过滤所得固体A的成分是Mg、Cu;
⑵溶液M中主要含有NaAlO2、Na2SiO3,加入过量盐酸,Na2SiO3与盐酸反应生成H2SiO3沉淀(固体B);溶液N中主要含有AlCl3,步骤③加入过量氨水与其反应生成Al(OH)3沉淀;
⑶步骤③洗涤沉淀表面上的可溶性杂质NaCl、NH4Cl;用AgNO3溶液可检验沉淀是否洗涤干净;
⑷据题意知固体C为Al?2O3,据铝原子守恒可计算出样品中铝的质量分数=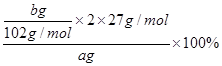 =
=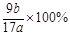 ;
;
⑸A项第①步中加入NaOH溶液不足,铝不能全部溶解,会导致结果偏小;B项第②步中加入盐酸不足时,氢氧化铝不能完全溶解,会导致结果偏小;C项第③步中沉淀未用蒸馏水洗涤会导致氧化铝含有杂质,其质量偏大,会使测定结果偏大;D项第④步对沉淀灼烧不充分,会导致氧化铝中含有氢氧化铝,将导致铝的含量偏大,综上分析可确定C、D项正确。
本题难度:一般