微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中各微粒的浓度关系不正确的是( )
A.0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L
B.NaHCO3溶液中:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+(OH-)
C.CH3COONa溶液中:c(Na+)>c(CH3COO-)>(OH-)>c(H+)
D.Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S)
2、选择题 关于醋酸溶液下列叙述错误的是?
[? ]
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.升高温度,溶液中c(H+)/c(CH3COOH)比值增大
C.CH3COOH溶液中加少量的CH3COONa固体,醋酸的电离平衡逆向移动
D.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
3、选择题 在相同温度下,100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量
B.电离的程度
C.H+的物质的量浓度
D.CH3COOH的物质的量
4、选择题 常温下,向l00mL 0.01 mol?L-1盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是(?)
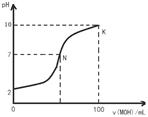
A.MOH是弱碱
B.N点c(Cl-) = c(M+)
C.随着MOH溶液的滴加,比值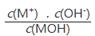 不变
不变
D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1
5、填空题 (10分)现有常温下的五份溶液:
①0.01 mol·L-1 CH3COOH溶液; ②0.01 mol·L-1 HCl溶液;
③pH=12的氨水; ④pH=12的NaOH溶液;
⑤0.01 mol·L-1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是______(填序号,下同),水的电离程度相同的是______;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(填“>”、“<”或“=”);
(3)将前四份溶液同等稀释10倍后,溶液的pH:
①________②,③________④ (填“>”、“<”或“=”);