微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积.下列叙述不正确的是( )
A.两反应中转移的电子数相等
B.消耗铝的质量相等
C.消耗NaOH溶液和盐酸的体积不相等
D.反应后两溶液混合会产生白色沉淀且溶液中的溶质只有NaCl
参考答案:发生反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
A、反应中铝作还原剂,氢气是还原产物,生成的氢气的体积相等,金属提供的电子相等,故A正确;
B、金属提供的电子相等,故消耗的铝的物质的量相等,故B正确;
C、参加反应的铝相等,分别生成NaAlO2、AlCl3,根据铝元素守恒NaAlO2、AlCl3物质的量相等,根据钠离子是故n(NaOH)=n(NaAlO2),根据氯离子守恒n(HCl)=3n(AlCl3),盐酸与氢氧化钠的浓度相同,故消耗的氢氧化钠与盐酸的体积之比等于1:3,故C正确;
D、足量铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,发生反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,假设生成的氢气的物质的量为3mol,生成n(AlCl3)=2mol,生成的n(NaAlO2)=2mol,将溶液混合后发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,2molAl3+需要6molAlO2-,铝离子有剩余,故产生白色沉淀且溶液中的溶质为NaCl、AlCl3,故D错误;
故选D.
本题解析:
本题难度:简单
2、计算题 将46g金属钠和54g金属铝同时放入足量的水中,最后得到5.0L溶质仅为偏铝酸钠的溶液。计算:
⑴得到的气体在标准状况下的体积。
⑵所得溶液中偏铝酸钠的物质的量浓度。
参考答案:67.2L 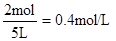
本题解析:略
解:n(Na)=2mol?n(Al)=2mol?
2Na?+? 2H2O?=? 2NaOH?+? H2↑
2mol? 2mol? 22.4L?
2Al?+ 2H2O?+? 2NaOH?=? 2NaAlO2?+? 3H2↑
2mol? 2mol? 2mol? 67.2L
⑵?得到的气体在标准状况下的体积为:22.4L+67.2L=89.6L?
⑵得到的溶液为NaAlO2溶液,其物质的量浓度为: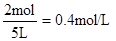
本题难度:一般
3、选择题 双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
A.该物质属于两性氢氧化物
B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+
D.该药剂不适合于胃溃疡患者服用
参考答案:D
本题解析:A、该物质中含有CO32-,因此该物质不属于两性氢氧化物,A不正确;B、该物质是纯净物,B不正确;C、该物质能电离出2个OH-与1个CO32-,因此与酸反应最多可消耗4 mol H+,C不正确;D、双羟基铝碳酸钠是医疗上常用的一种抑酸剂,但与酸反应会产生CO2气体,所以该药剂不适合于胃溃疡患者服用,D正确,答案选D。
本题难度:一般
4、选择题 由Al3+→Al(OH)3→AlO2-→□→Al3+系列变化中,□中应填写的是
[? ? ]
A.Al(OH)3
B.AlCl3
C.HCl
D.NaOH
参考答案:A
本题解析:
本题难度:简单
5、选择题 铝具有较强的抗腐蚀能力,主要原因是?
A.铝的化学性质稳定
B.铝与氧气在常温下不反应
C.铝在任何条件下均不与氧气反应
D.铝与氧气化合形成一层致密 的氧化膜
的氧化膜
参考答案:D
本题解析:略
本题难度:简单