微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法?
该法的工艺流程为?

其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显?色。
(2)能说明第①步反应达平衡状态的是??。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)?
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。?
(4)用Fe做电极的原因为??。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) ??。
溶液中同时生成的沉淀还有?。
参考答案:
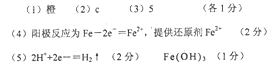
本题解析:(1)平衡体系的pH=2,即溶液为酸性溶液,则溶液显橙色;
(2)能说明第①步反应达平衡状态的是:溶液的颜色不变即各组分的浓度保持不变的状态;
(3)由Ksp=c(Cr3+)?c3(OH-)=10-32,可得,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(4)用Fe做电极的原因为:Fe为阳极,发生氧化反应,生成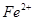 ,提供还原剂
,提供还原剂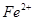 ,其电极反应式为:
,其电极反应式为: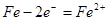 ;
;
(5)在阴极附近溶液pH升高的原因是: 。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
本题难度:一般
2、选择题 下列各项中的两个量,其比例为2:1的是(?)
A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比
C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积
D.0.2mol/L的NaHSO3溶液中的阳离子与阴离子的浓度之比
参考答案:A
本题解析:略
本题难度:简单
3、选择题 某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液。观察到如下现象:
①CuS不溶于醋酸溶液;
②CuS不溶于浓盐酸;
③CuS不溶于浓硫酸;
④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生。
根据上述现象,该同学得出了以下结论,其中正确的是
[? ]
A.CuS不溶于弱酸,能溶于强酸
B.CuS不溶于非氧化性酸,能溶于氧化性酸
C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使沉淀溶解平衡向溶解方向移动
D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使沉淀溶解平衡向溶解方向移动
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol ?L-1,向该溶液中逐滴加入0.010 mol ?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42-
D.Br-、CrO42-、Cl-
参考答案:C
本题解析:在一定温度下,在难溶化合物的饱和溶液中组成沉淀的各离子的浓度的乘积是一常数,称溶度积常数。运用Ksp的公式进行计算,只要注意到AgCl、AgBr和Ag2CrO4的Ksp表达式不同,计算银离子的浓度即可。
c(Ag+)=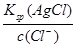 =
=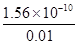 = 1.56×10-8
= 1.56×10-8
c(Ag+)=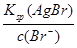 =
=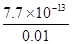 = 7.7×10-11
= 7.7×10-11
c(Ag+)=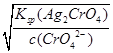 =
=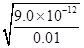 =3.0×10-5
=3.0×10-5
根据计算可知,三种离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,选项C正确。
【考点定位】沉淀溶解平衡、溶度积常数
本题难度:一般
5、选择题 向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为
[? ]
A.AgCl=AgI=Ag2S
B.AgCl<AgI<Ag2S
C.AgCl>AgI> Ag2S
D.AgI>AgCl> Ag2S
参考答案:C
本题解析:
本题难度:一般