微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去CO2中的HCl杂质最好是将混合气体通过足量的( )
A.饱和NaOH溶液
B.饱和NaHCO3溶液
C.饱和Na2CO3溶液
D.水
参考答案:A.氢氧化钠会吸收二氧化碳和氯化氢,把二氧化碳也除去了,故A错误;
B.NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,在除去氯化氢的同时增加了二氧化碳的量,故B正确;
C.Na2CO3溶液能够与二氧化碳反应,把二氧化碳也除去了,故C错误;
D.二氧化碳在水中的溶解度较大,把二氧化碳也除去了,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 下列除杂方案错误的是
选项
| 被提纯的物质
| 杂质
| 除杂试剂
| 除杂方法
|
A.
| CO(g)
| CO2(g)
| NaOH 溶液、浓H2SO4
| 洗气
|
B.
| NH4Cl(aq)
| Fe3+(aq)
| NaOH溶液
| 过滤
|
C.
| Cl2(g)
| HCl(g)
| 饱和食盐水、浓H2SO4
| 洗气
|
D.
| Na2CO3(s)
| NaHCO3(s)
| —
| 灼烧
参考答案:B
本题解析:A项依次通过NaOH 溶液、浓 H2SO4,分别除去CO2,水蒸气,正确;B项NaOH溶液与NH4Cl也反应,错误;C项依次通过饱和食盐水、浓H2SO4,分别除去HCl,水蒸气,正确;D项通过灼烧能使NaHCO3固体分解生成Na2CO3,正确。
本题难度:一般
3、选择题 下列叙述正确的是(NA为阿伏伽德罗常数)
A.标况下,22.4L苯的分子数为NA
B.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4?NA
C.0.5?mol?L-1?CuCl2溶液中含有0.5NA个Cu2+
D.标准状况下,22.4?L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
参考答案:B
本题解析:分析:A、苯在标准状况下不是气体;
B、依据氧化还原反应化学方程式结合过氧化钠自身氧化还原反应时,每1mol过氧化钠反应转移电子为1mol,生成0.5mol氧气;
C、铜离子水解;
D、氯气和氢氧化钠反应,氯气自身氧化还原反应,1mol氯气反应电子转移电子为1mol.
解答:A、苯在标准状况下不是气体,标况下,22.4L苯物质的量不是1mol,分子数不是NA,故A错误;
B、每1mol过氧化钠反应转移电子为1mol,生成0.5mol氧气;Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4 NA,故B正确;
C、铜离子水解,0.5 mol?L-1 CuCl2溶液中含有Cu2+小于0.5NA个,故C错误;
D、氯气自身氧化还原反应,1mol氯气反应电子转移电子为1mol;标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,氧化还原反应的电子转移计算方法,盐类水解的应用,难度中等.
本题难度:简单
4、填空题 多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 ? 2H2O,工艺流程如下:
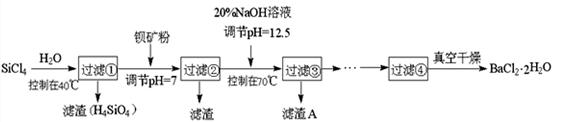
已知: ① 常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197; BaCl2 ? 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式__________________________________
(2)高温下,SiCl4 (g) 用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收
59 kJ热量,则该反应的热化学方程式为__________________________________
(3)加钡矿粉调节pH=7来源:91考试 网的作用是:
①使BaCO3转化为BaCl2?②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2 ? 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 ? 2H2O___________吨。
参考答案:(1)SiCl4+4H2O=H4SiO4↓+4HCl (2分,写成H2SiO3且配平可给1分)
(2)SiCl4(g)+2H2(g)=Si(s)+4HCl(g)?△H= +236 kJ/mol?(2 分)
(3)使Fe3+ 完全沉淀 (1分)?
(4)Mg2++2OH- = Mg(OH)2↓( 1分)
(5)蒸发浓缩,降温结晶(2分)?
(6)9.76 (2 分)
本题解析:(3)常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4,加钡矿粉调节pH=7的另一作用为使Fe3+ 完全沉淀
(6)反应关系式为
BaCO3~BaCl2·2H2O
197?244
10×78.8%? m
m=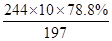 =9.76吨 =9.76吨
本题难度:困难
5、选择题 在标准状况下,将1克氦气,11克CO2和4克O2混合,所得混合气的体积约为
A.28L
B.11.2L
C.16.8L
D.14.0L
参考答案:D
本题解析:试题分析:在标准状况(273.15 K、101kPa)下,任何气体的摩尔体积约为22.4 L,所以该混合气的体积 。所以答案选D。 。所以答案选D。
考点:气体摩尔体积
点评:本题考查了气体摩尔体积的计算,该考点是高考考查的重点和难点,解题的关键是要理解在标准状况(273.15 K、101kPa)下,任何气体的摩尔体积约为22.4 L。本题难度适中。
本题难度:困难
|