微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列除杂或鉴别方法正确的是
A.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
B.用点燃的方法除去CO2中的CO
C.用加热法除去Na2CO3溶液中的NaHCO3
D.用品红溶液或酸性KMnO4溶液鉴别 CO2和SO2
参考答案:D
本题解析:
正确答案:D
A.不正确,用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液,两者均产生沉淀。
B. 不正确,无法用点燃的方法除去CO2中的CO,引入O2,,或点不着;
C. 不正确,用加热溶液中的NaHCO3,达不到分解温度。
本题难度:一般
2、选择题 下列装置不能达到相应实验目的的是(?)?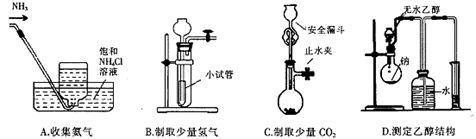
参考答案:A
本题解析:
氨气极易溶于水,不能用排水法收集,氨气密度小于空气,应该用向下排空气法收集氨气,故A答案错误,选A。
本题难度:简单
3、实验题 实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
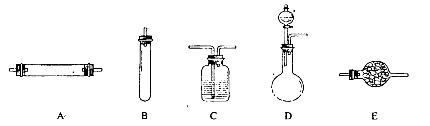
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.
参考答案:(1)D; CaO和水反应,减少了溶剂;CaO和水反应放热,降低了氨气的溶解度。
(2)E?碱石灰
(3)NaNO2+NH4Cl NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(4)Cu和CuO可以循环使用,节省试剂;避免使用有毒物质NaNO2而造成污染,
(5)方法二制的氮气含有稀有气体的密度比氮气密度大,所以导致氮气密度偏大
本题解析:(1)用CaO和浓氨水反应,应选固液常温型的发生装置,即D;浓氨水常温下跟生石灰反应生成氨气和氢氧化钙,化学方程式为CaO+NH3?H2O=NH3↑+Ca(OH)2,因为氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程中,生石灰的两个作用是:一方面消耗氨水溶液中的水,另一方面放出的热量促使氨水挥发、分解而得到氨气;
(2)空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂-碱石灰,既可以吸收二氧化碳又能吸收水;
(3)根据信息反应物是亚硝酸钠(NaNO2)和氯化铵,反应条件是加热,氮元素全部转化为氮气,反应前后元素的种类不变,因此生成物还有氯化钠和水,因此反应的方程式为:
NaNO2+NH4Cl NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(4)从题中信息可知,NH3和CuO生成Cu和N2而空气和Cu生成CuO,故Cu和CuO可以循环使用,方法三使用有毒的亚硝酸钠,方法一和二避免使用有毒物质而造成污染,因此联合使用方法一和方法二与单独使用方法三相比的优点有:铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染).
(5)将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末只是除去了氧气,其中还含有稀有气体等杂质,由于稀有气体的密度比氮气密度大,所以导致氮气密度总是偏大5‰左右;
本题难度:一般
4、实验题 (共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
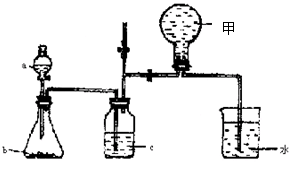
①气体X的分子式是?。
②所选择的药品a是?,b是?, c是?。
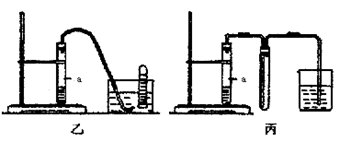
③下列装置乙和丙,能代替装置甲的简易装置是?(填“乙”或“丙”)
④请写出在试管a中所发生反应的化学方程式?。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出?;?;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为?(填“正确”或“不正确”),依据是:?;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象:?。
参考答案:(1)?① NO?② a稀硝酸? b铜屑? c蒸馏水?③乙?
④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O?
⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色,又变无色;?
(2)不正确?依据是:铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同。?
方案及实验现象:将绿色溶液加热,有红棕色气体产生,溶液变成蓝色,说明后一种推断正确。或:将溶液稀释,溶液变蓝色(其它合理方案均可)
本题解析:(1)①结合所给试剂可看出,可以制取的气体包括H2S、SO2、CO2、NO、NO2等,再结合所给装置,在不加热的情况下能制取的不溶于水的气体只有NO
②依据反应原理3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知, a稀硝酸? b铜屑;而为水,可除去NO中的NO2
③NO只能用排水法来收集,故选乙装置即可
④3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
⑤试管a的溶液中有无色气泡产生;试管a上部空间气体由无色变成红棕色:2NO+O2=2NO2,又变无色3NO2+H2O=2HNO3+NO;
(2)铜片质量相同,生成铜离子的物质的量相同,溶液体积相同且硝酸过量,故生成的Cu2+的浓度相同,不可能导致溶液颜色的不同
假如溶液呈绿色是由Cu2+与NO2混合的结果,可加热使NO2逸出,可将溶液稀释(3NO2+H2O=2HNO3+NO)即可
本题难度:简单
5、选择题 既能用浓H2SO4干燥,又可用CaO干燥的气体有①H2 ②O2 ③N2 ④SO2 ⑤H2S ⑥CH4 ⑦NH3 ⑧CO2( )
A.①②③⑥
B.①②③⑧
C.④⑤⑥
D.④⑤
参考答案:①H2是中性气体,且其还原性只有在加热条件下才能体现,所以它既能用浓H2SO4干燥,又可用CaO干燥,故正确.
②O2是中性气体,和浓硫酸、氧化钙都不反应,所以它既能用浓H2SO4干燥,又可用CaO干燥,故正确.
③N2是中性气体,和浓硫酸、氧化钙都不反应,所以它既能用浓H2SO4干燥,又可用CaO干燥,故正确.
④SO2 是酸性气体,能和氧化钙反应,所以不能用氧化钙干燥,故错误.
⑤H2S是酸性气体,且是还原性气体,所以它既不能用浓硫酸干燥也不能用氧化钙干燥,故错误.
⑥CH4是中性气体,和浓硫酸、氧化钙都不反应,所以它既能用浓H2SO4干燥,又可用CaO干燥,故正确.
⑦NH3 是碱性气体,能和浓硫酸反应,所以不能用浓硫酸干燥,故错误.
⑧CO2是酸性气体,能和氧化钙反应,所以不能用氧化钙干燥,故错误.
故选A.
本题解析:
本题难度:简单