微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有几个实验小组的同学,利用下图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质。
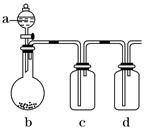
请你回答以下各组同学在交流实验设计方案中提出的问题:
Ⅰ.(1)若a:浓盐酸;b:高锰酸钾(其氧化性比二氧化锰强很多);c:红色鲜花瓣。在实验过程中c中的现象_____________________________________________________________。
d装置中盛放药品的作用是______________________________,请写出d中反应的离子方程式: ___________________________________________________________________。
(2)若a:稀盐酸;b:贝壳粉;c:饱和碳酸钠溶液;d:饱和Na2SiO3溶液。在实验过
程中,c中出现的现象是____________________。d中现象是____________,这说明
________________________________________________________________________。
Ⅱ.你认为四组同学在制取气体之前都应进行的操作是________________。你还可以利用此装置的a和b两部分制取的气体有(只写一种)_________________。
参考答案:Ⅰ.(1) 花瓣褪色
吸收未反应的氯气,防止污染空气
Cl2+2OH-=Cl-+ClO-+H2O
(2)有白色沉淀析出 ?出现胶状物质 ?生成不溶性的硅酸,即硅酸的酸性弱于碳酸
Ⅱ.装置气密性检查 ?氧气(或二氧化硫)(合理答案均可)
本题解析:Ⅰ(1)氯气与水反应生成盐酸和次氯酸,干燥的氯气无漂白作用,氯气与水生成的次氯酸有漂白作用,由于氯气有毒,故用碱液吸收,红色鲜花瓣中有水能生成次氯酸,故答案为:花瓣褪色;吸收未反应的氯气,防止环境污染;Cl2+2OH-=Cl-+ClO-+H2O;(2)盐酸与贝壳粉(主要成分为碳酸钙)反应生成二氧化碳,二氧化碳与硅酸钠反应生成硅酸,由于硅酸是难溶于水的,故有白色沉淀析出;故答案为:有白色沉淀析出;?出现浑浊;苯酚的酸性弱于碳酸;Ⅱ制取气体之前都应进行的操作是装置气密性检查。装置的a和b组成的仪器属于固液不加热来制气类型,可以制备 氧气(或二氧化硫)。
本题难度:一般
2、选择题 实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是

选项
| I中的物质
| II中收集的气体
| III中的物质
|
A
| Cu和浓硝酸
| NO
| NaOH溶液
|
B
| 浓盐酸和MnO2
| Cl2
| NaOH溶液
|
C
| 碳酸钙和盐酸
| CO2
| 澄清石灰水
|
D
| 浓氨水和CaO
| NH3
| 酚酞溶液
|
?
参考答案:C
本题解析:通过对装置图的分析知,发生装置中不需要加热,则B项错误;收集装置属于向上排空收集法(气体的密度比空气大),则A、D项错误;故答案选C。
本题难度:简单
3、实验题 现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:


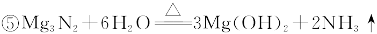
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。

回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________________
_______________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)______________________________。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? __________,原因是_____________________________________________________________________________。
(4)请设计一个实验,验证产物是氮化镁:________________________________________
_______________________________________________________________________________。
参考答案:(1)B 目的是除气流中的水蒸气,避免反应④发生;D 目的是除空气中的CO2,避免反应③发生;F 目的是除空气中的氧气,避免反应①发生
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)使氮化镁不纯 如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧气同镁反应,而使氮化镁中混入氧化镁
(4)取适量产物放入试管中,滴加蒸馏水,加热,将湿润的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
本题解析:(1)因Mg能与O2、CO2、H2O发生反应,应除去空气中的H2O、O2、CO2,用B来除去空气中的水蒸气,用D来除去空气中的CO2,用F来除去空气中的O2。
(2)除去空气中的H2O、O2、CO2的顺序应先除CO2再除去水蒸气,最后除去O2。
(3)如果同时点燃A、F装置的酒精灯,A中硬质玻璃管中空气没有排尽,这时Mg会与H2O、CO2、O2等反应,生成物会不纯。
(4)由于Mg3N2与水能发生水解反应,生成Mg(OH)2和NH3,因此可以用湿润的红色石蕊试纸来检验是否产生NH3即可验证有无Mg3N2生成。
本题难度:简单
4、填空题 (15分)氯化铁是常见的水处理剂,无水氯化铁的熔点为555K、沸点为588K。工业制备氯化铁的一种工艺如下:
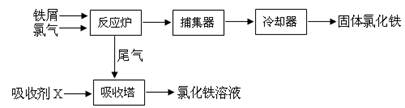
回答下列问题
(1)取0.5mL氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为?。
(2)已知FeCl3·6H2O在水中的溶解度如下:
温度/℃
| 0
| 10
| 20
| 30
| 50
| 80
| 100
|
溶解度(g/100gH2O)
| 74.4
| 81.9
| 91.8
| 106.8
| 315.1
| 525.8
| 535.7
|
从FeCl3溶液中获得FeCl3·6H2O的方法是?。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为?。
(4)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤1.0×10-5 mol·L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为?(已知Ksp[Fe(OH)3]=1.0×10-38)。
(5)吸收剂X是?,吸收塔中吸收剂X的作用是?。
(6)测定样品中FeCl3的质量分数的方法是:
a.称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容
b.取出10mL待测溶液于锥形瓶中,加入稍过量的KI溶液充分反应
c.以淀粉作指示剂,用b mol·L-1Na2S2O3溶液滴定(I2+2 Na2S2O3= Na2S4O6+2NaI),共用去VmL。①样品中氯化铁的质量分数为?。
②若用上述办法测定的样品中FeCl3的质量分数偏低(测定过程中产生的误差可忽略),其原因可能是?。
参考答案:共15分
(1)Fe3++3H2O Fe(OH)3(胶体)+3H+?(2分,漏写胶体扣1分)
Fe(OH)3(胶体)+3H+?(2分,漏写胶体扣1分)
(2)加入少量盐酸,加热浓缩,再冷却结晶(2分,不答出加少量盐酸不得分)
(3)Fe2Cl6(2分)
(4)3(1分)
(5)FeCl2溶液(1分),吸收反应炉中过量的氯气和少量氯化铁烟气(2分)
(6)①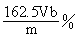 (3分)②样品中含有杂质FeCl2(2分)
(3分)②样品中含有杂质FeCl2(2分)
本题解析:(1)该过程为Fe(OH)3(胶体)的制备,所以反应的离子方程式为:Fe3++3H2O Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(2)在FeCl3溶液中,由于Fe3+是弱碱阳离子,存在如下水解过程:Fe3++3H2O?Fe(OH)3+3H+,而水解是吸热过程,温度越高越易水解,所以,为了抑制Fe3+的水解,在加热浓缩氯化铁溶液前,要加入少量盐酸,又由于FeCl3·6H2O的溶解随温度的升高而升高的,所以,在FeCl3溶液中得到FeCl3·6H2O的方法,可采用:加入少量盐酸,加热浓缩,再冷却结晶。
(3)因为FeCL3的相对分子质量为162.5,所以捕集器中温度超过673K,存在相对分子质量为325的物质为Fe2Cl6。
(4)根据Ksp[Fe(OH)3]=1.0×10-38,所以
c(Fe3+)·c3(OH-)=1.0×10-38
c(Fe3+)=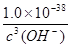 ≤1.0×10-5 mol·L-1
≤1.0×10-5 mol·L-1
c3(OH-)≥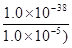
c(OH-)≥1.0×10-11 mol·L-1
?即: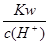 ≥1.0×10-11
≥1.0×10-11
得:c(H+)≤1.0×10-3
pH≥3
(5)因为从吸收塔中出来成分为FeCL3溶液,而从反应炉中出来的尾气中含有过量的氯气和少量的氯化铁烟气,所以,吸收剂为FeCl2溶液,其作用为吸收反应炉中过量的氯气和少量氯化铁烟气。
(6)①消耗Na2S2O3的的物质的量为Vb×10-3mol;由反应方程式I2+2 Na2S2O3= Na2S4O6+2NaI可知,反应的I2的物质的量为1/2Vb×10-3mol,又因为2Fe3++2I-==2Fe2++I2,故FeCl3的物质的量为Vb×10-3mol,所以在100mL溶液中,FeCl3的物质的量为Vb×10-2mol,
得质量分数为:(Vb×10-2mol×162.5)/m ==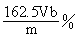 。
。
②若用上述办法测定的样品中FeCl3的质量分数偏低,则说明样品还含有还原性的物质存在,故,样品中含有杂质FeCl2
本题难度:一般
5、填空题 利用图所示装置收集以下6种气体(图中烧瓶的位置不得变化)。 ①H2②Cl2 ③CH4 ④HCl ⑤NH3⑥SO2 若烧瓶是干燥的,则由A口进气,可收集的气体有(写序号); ____? ;
参考答案:①③⑤
本题解析:
本题难度:一般