微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)某同学在学习了氨的性质以后,运用类比的思想思考:(1)其他气体在一定情况下能否像氨气一样也形成喷泉?(2)氨气具有还原性,能否像H2那样还原CuO呢?于是他设计实验制取氨气并探究上述问题。请你参与他的活动并完成下列研究:
(Ⅰ)制取氨气及喷泉现象的探究
1.写出实验制取氨气的化学方程式?;
2.收集氨气的方法是?。
3.喷泉是一种常见的自然现象。
(1)图1为化学教材中的喷泉实验装置。该生积极思考,只要满足烧瓶内压强与玻璃管水柱压强的和小于烧瓶外的压强就可以产生喷泉。于是他设计了图2和图3所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是__________。?
A.Cu和稀盐酸? B.NaHCO3与NaOH溶液? C.MnO2与稀盐酸?D.Na2CO3与稀盐酸
②在图3锥形瓶中加入易挥发物质(如酒精),水槽中加入冷水后,再加入下列的物质足量,结果也产生了喷泉。水槽中后加入的物质可以是___________。
A.浓硫酸?B.食盐?C.生石灰?D.蔗糖

(2)城市中常见的人造喷泉及火山爆发的原理与上述___________(从“图1”或“图2”中选择)装置的原理相似。
(Ⅱ)该小组中某同学设计了下列所示的实验
装置(夹持及尾气处理装置未画出),探究氨气
的还原性:
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是?。(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式?。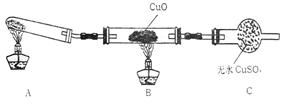
参考答案:(Ⅰ)1.2NH4Cl + Ca(OH)2  CaCl2+2NH3↑+2H2O (3分)
CaCl2+2NH3↑+2H2O (3分)
2.向下排空气法(2分)
3.(1)①2分)②AC(2分),(2)图2…(2分)
(Ⅱ)(1)在装置A与B之间增加装有碱石灰的干燥管(其他合理答案均得分)(2分)
(2)3CuO+2NH3 3Cu+ +3H2O(2分)
3Cu+ +3H2O(2分)
本题解析: (Ⅰ)1.实验室制取氨气采用氯化铵和熟石灰混合加热的方法。2.因为氨气的密度比空气小,所以采用向下排空气法收集,但不能采用排水法(氨气极易溶于水);3. (1)①只有D项在常温下才能反映生产气体;②乙醇挥发,必须加入,只有浓硫酸、生石灰遇水放出大量的热量;(Ⅱ)(1)制取的气体可能不干燥,所以必须经过干燥后在反应,即在装置A与B之间增加装有碱石灰的干燥管;CuO变为红色物质Cu,无水CuSO4变蓝色,说明生成水,无污染的气体就是N2。所以方程式为3CuO+2NH3? 3Cu+ +3H2O。
(Ⅰ)1.实验室制取氨气采用氯化铵和熟石灰混合加热的方法。2.因为氨气的密度比空气小,所以采用向下排空气法收集,但不能采用排水法(氨气极易溶于水);3. (1)①只有D项在常温下才能反映生产气体;②乙醇挥发,必须加入,只有浓硫酸、生石灰遇水放出大量的热量;(Ⅱ)(1)制取的气体可能不干燥,所以必须经过干燥后在反应,即在装置A与B之间增加装有碱石灰的干燥管;CuO变为红色物质Cu,无水CuSO4变蓝色,说明生成水,无污染的气体就是N2。所以方程式为3CuO+2NH3? 3Cu+ +3H2O。
本题难度:简单
2、填空题 氮及其化合物在工农业生产等方面有广泛应用,研究其性质有重要意义。
A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按如图装置,引发紫色石蕊溶液上喷,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体C。用圆底烧瓶收集干燥的C,仍按下图装置,引发紫色石蕊溶液上喷,可以得到红色喷泉。
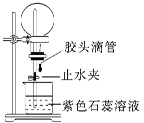
(1)写出A与浓NaOH溶液共热生成B的离子方程式
?;
(2)可用于除去B中水分的干燥剂是______________;
收集气体C的方法是______________________________;
(3)引发紫色石蕊溶液上喷的操作是?;
(4)在同温同压下,相同体积的两个烧瓶分别充满气体B和气体C,做喷泉实验后,水都充满烧瓶,两个烧瓶中所得溶液的物质的量浓度之比是_____________。
参考答案:(10分)(1)NH+OH-NH3↑+H2O (2)碱石灰向上排空气法
(3)打开止水夹,挤出胶头滴管中的水 (4)1:1
本题解析:(1)碱液能使石蕊试液显蓝色,则气体B应该是氨气,所以A应该是铵盐。A与浓H2SO4反应,放出无色气体C。且用无色气体C做喷泉实验可以得到红色喷泉,这说明C应该是氯化氢,所以A是氯化铵,则A与浓NaOH溶液共热生成B的离子方程式是NH+OH-NH3↑+H2O。
(2)氨气是碱性气体,不能用酸性干燥剂,也不能用氯化钙,应该用碱石灰做干燥剂。氯化氢极易溶于水,但氯化氢的密度大于空气的,所以收集氯化氢的方法是向上排空气法。
(3)引发紫色石蕊溶液上喷的操作是打开止水夹,挤出胶头滴管中的水。
(4)在相同条件下,等体积的氨气和氯化氢的物质的量是相等的,又因为水充满烧瓶,所以两个烧瓶中所得溶液的物质的量浓度之比是1:1的。
点评:该题是高考中的常见考点和题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养,有利于提升学生的学科素养,也有利于培养学生规范、严谨的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、选择题 将标准状况下NO2和O2按体积比4∶1混合后充入一干燥烧瓶中,把烧瓶倒置于水中,烧瓶内液体逐渐上升,若不考虑烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为?( ? )
A.mol·L-1
B.× mol·L-1
C.× mol·L-1
D.mol·L-1
参考答案:C
本题解析:4NO2+O2+2H2O=4HNO3?设烧瓶体积是V,那么NO2的体积是4V/5,物质的量为
V×,生成的硝酸的物质的量和NO2相同,最终烧瓶中的溶液是HNO3,物质的量浓度为物质的量除以烧瓶的体积,所以应该是× mol·L-1,故选C。
本题难度:一般
4、选择题 氮族元素与同周期的碳族、氧族元素相比较,下列变化规律正确的是(?)
A.原子半径:C<N<O
B.非金属性:Si>P>S
C.稳定性:SiH4>PH3>H2S
D.酸性强弱:H2SiO3<H3PO4<H2SO4
参考答案:D
本题解析:氮族元素在周期表中位于碳族元素的右侧,位于氧族元素的左侧,化学性质介于碳族和氧族元素之间。根据元素周期律不难判断只有D正确。
本题难度:简单
5、选择题 下列过程没有起到氮的固定作用的是
A.N2与O2反应生成NO
B.NH3经催化氧化生成NO
C.N2和H2在一定条件下合成氨
D.豆科植物的根瘤菌将空气中的氮气转化为含氮化合物
参考答案:B
本题解析:氮的固定是指从游离态转化成化和态度过程,所以可以看到,NH3经催化氧化生成NO。
是从化合态到化合态的转化,不符合定义,故选B。
点评:熟悉氮的固定的定义,能熟练运用定义去解决实际问题,考试时不考定义,只考察应用,所以一定要准确把握实质。
本题难度:简单