| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《弱电解质电离平衡》答题技巧(2017年最新版)(四)
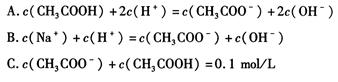 参考答案:(1)c(Na+)>c(CHCOO-)>c(OH-)>c(H+)?(2)? C?(3)? ABC 本题解析:盐类的水解程度小,且醋酸钠溶液为碱性,所以离子浓度大小顺序为 本题难度:一般 2、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂 |
参考答案:B
本题解析:①盐酸,C(H+)增大,平衡逆向移动,显红色;②石灰水,消耗H+,则C(H+)减小,平衡正向移动,显黄色;③NaCl溶液,不影响平衡移动;④NaHSO4溶液中,会电离出H+,则C(H+)增大,平衡逆向移动,显红色;⑤NaHCO3溶液水解显碱性,消耗H+,则C(H+)减小,平衡正向移动,显黄色;⑥氨水同②石灰水,消耗H+,则C(H+)减小,平衡正向移动,显黄色
本题难度:一般
3、选择题 属于强电解质的是①NaOH ②NH3·H2O ③CaCO3 ④CH3COOH⑤NaHCO3⑥氢氧化铝⑦氯化铵⑧二氧化碳⑨乙醇⑩铜
A.①③⑤⑦
B.②④⑥⑦
C.①③⑥⑦
D.⑧⑨⑩
参考答案:A
本题解析:强电解质主要包括强酸、强碱和盐类,①NaOH 是强碱,②NH3·H2O 是弱碱,③CaCO3属于盐类,是强电解质,④CH3COOH是弱酸,⑤NaHCO3属于盐类,是强电解质,⑥氢氧化铝属于弱碱,是弱电解质,⑦氯化铵属于盐类,是强电解质, ⑧二氧化碳是非电解质,⑨乙醇是非电解质,⑩铜不属于电解质。选A。
考点:强弱电解质的判断。
本题难度:一般
4、选择题
A.NaOH(s)
B.H2O
C.NH4Cl(s)
D.CH3COONa(s)
参考答案:BD
本题解析:A.加NaOH固体能减缓反应速率,但要消耗H+,减少氢气总量。C.NH4Cl固体不与盐酸反应,又不影响溶液的体积。在强酸性条件下不考虑其中水解。B.水既不影响溶液中H+的物质的量,又能稀释盐酸。D.CH3COONa能与盐酸生成弱电解质CH3COOH减缓反应速率,但不能影响H2总量。
本题难度:简单
5、填空题 (16分)
(1)已知298K时,Fe(OH)3的溶度积常数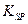 =2.6×10-39,Mg(OH)2的溶度积常数
=2.6×10-39,Mg(OH)2的溶度积常数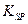 =5.6×
=5.6× ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:?
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为?(填序号).
a.一元强酸? b. 一元弱酸? c. 二元强酸? d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有?溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ .过程③的转化需要在HCl气流中加热,HCl的作用是?
.过程③的转化需要在HCl气流中加热,HCl的作用是?
ⅲ.写出过程④中发生反应的化学方程式?
参考答案: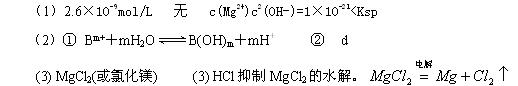
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的量浓.. | |