|
高考化学试题《原电池原理》答题技巧(2017年最新版)(六)
2017-08-26 00:50:27
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图各装置中,电解质溶液均为硫酸铜溶液,其中一定不能构成原电池的是( )
A.
B.
C.
D.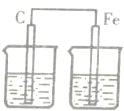
参考答案:题中B、C都符合原电池的构成条件,所以能构成原电池,而A中锌先置换出铜,然后可形成原电池反应,但D没有形成闭合回路,则不能形成原电池.
故选D.
本题解析:
本题难度:简单
2、填空题 (12分)
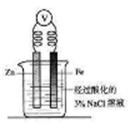
【小题1】下图为牺牲阳极的阴极保护法的实验装置,此装置 中Zn电极上的电极反应为 ;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是 ,发生的反应的离子方程式是 。
【小题2】CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I- = 2CuI↓ + I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。①电解开始不久,阴极产生的实验现象有 ,阴极的电极反应是 。
②阳极区溶液变蓝色,同时伴随的现象还有 ,对阳极区溶液
呈蓝色的正确解释是 。
A.2I- - 2e- = I2;碘遇淀粉变蓝
B.Cu - 2e- = Cu2+;Cu2+显蓝色
C.2Cu + 4I-- 4e- =" 2CuI↓" + I2; 碘遇淀粉变蓝
D.4OH-- 4e- = 2H2O + O2;O2将I-氧化为I2,碘遇淀粉变蓝
|
参考答案:
【小题1】Zn - 2e-= Zn2+ 产生蓝色沉淀(2分)
3Fe2+ + 2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓(2分)
【小题2】①产生气泡,溶液变红(2分); 2H+ + 2e-= H2↑(2分) ②产生白色沉淀,铜片溶解;C(各2分)
本题解析:(1)锌比铁活泼,作负极失去电子,被氧化,反应式为)Zn - 2e-= Zn2+。如果将Zn换成Pt,则铁是负极,失去电子被氧化生成亚铁离子。原因亚铁离子能和[Fe(CN)6]3-反应生成带有特征蓝色的铁氰化亚铁沉淀,反应式为3Fe2+ + 2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓。
(2)铜作阳极失去电子被氧化生成铜离子,在阴极上溶液中的氢离子放电生成氢气。由于氢离子是水电离出的,因此随着氢离子的放电,阴极周围水的电离平衡将被破坏,使得氢离子浓度降低,OH-浓度增大,溶液显碱性。
(3)由于阳极产生铜离子,因此铜离子可以氧化溶液中的碘离子生成单质碘和碘化亚铜白色沉淀。因为铜离子被消耗,所以溶液显蓝色,不是因为铜离子的原因,而是由于生成的单质碘遇到淀粉而产生的。
本题难度:一般
3、填空题 银器皿日久表面变黑,这是由于生成硫化银,有人设计用原电池原理加以除去,其方法是:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间,黑色会褪去而银不会损失。试回答:在原电池反应中,负极发生的反应为?;正极发生的反应为?;反应过程中有臭鸡蛋气味气体产生,则原电池的总反应方程式为?。
参考答案:2Al-6e-=2Al3+
3Ag2S+6e-=6Ag+3S2-
3Ag2S+2Al+6H2O=2Al(OH)3↓+3H2S↑+6Ag
本题解析:本题是利用电化学知识把表面已经被硫化氢腐蚀的银器还原为银。利用原电池反应,将铝作为原电池的负极,表面被硫化氢腐蚀的银器作为正极,发生如下反应:负极的反应为2Al-6e-=2Al3+,正极的反应为3Ag2S+6e-=6Ag+3S2-,总反应为3Ag2S+2Al+6H2O=2Al(OH)3↓+3H2S↑+6Ag。
本题难度:一般
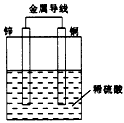
4、选择题 关于如图所示装置的叙述,正确的是
[? ]
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列有关原电池和金属腐蚀的说法错误的是( )
A.普通锌锰干电池碳棒是负极,锌片是正极
B.盛水的铁器,在空气与水交界处更容易锈蚀最厉害
C.为防止金属的腐蚀可在金属表面涂油漆、油脂
D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产氢速度快
参考答案:A
本题解析:
本题难度:一般
|