微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在按下图装置进行电解的过程中,通电一段时间后发现乙烧杯中铁电极的质量增加。

(1)乙烧杯中,两极发生的电极反应是
阴极:_____________________阳极:______________________
(2)甲烧杯中发生反应的化学方程式是:_____________________
(3)由左到右碳-碳-铁-银四个是极上析出或溶解物质的物质的量之比是_____________________。
参考答案:(1)阴极:Ag++e-=Ag;阳极:Ag-e-=Ag+
(2)2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
(3)2 :1 :4 :4
本题解析:
本题难度:一般
2、填空题 下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。
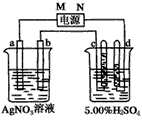
通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:
2∶____________∶____________∶____________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,AgNO3溶液的pH
____________,H2SO4溶液的浓度____________,H2SO4溶液的pH____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为____________g。
参考答案:(1)正
(2)Ag;2.16
(3)2∶0.5∶1
(4)不变;不变;增大;减小
(5)45.18
本题解析:
本题难度:一般
3、选择题 (2014届浙江省金丽衢十二校高三第二次联考理综化学试卷)
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融) 4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融?氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融?氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是

A.电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na
B.盖·吕萨克法制钠原理是嫡的增加带动了反应的进行
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
参考答案:C
本题解析:
A、电解池中阴极得到电子发生还原反应,则电解熔融氢氧化钠制钠,阴极发生电极反应为Na++e-=Na,A正确;B、根据反应式3Fe+4NaOH=Fe3O4+4Na↑+2H2↑可知,该反应是熵值增加的反应,因此盖·吕萨克法制钠原理是嫡的增加带动了反应的进行,B正确;C、根据反应方程式可知,若制得1mol钠,则戴维法与盖·吕萨克法中转移电子的物质的量是1mol、2mol,C不正确;D、电解池中阳极失去电子,阴极得到电子,因此用电解熔融氯化钠法制钠时,电解槽中石墨极为阳极,铁为阴极,则D正确,答案选C。
本题难度:一般
4、选择题 关于铅蓄电池的说法正确的是
[? ]
A.在放电时,正极发生的反应是Pb(s) +SO42-(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
参考答案:B
本题解析:
本题难度:一般
5、填空题 (16分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
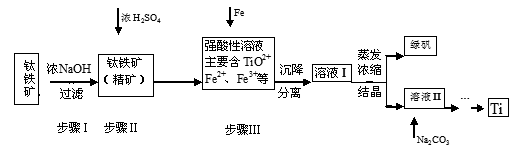
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度(s)与pH关系如图,TiO(OH)2溶度积Ksp=1×10-29

①步骤Ⅲ加入铁屑原因是 。
②TiO2+水解的离子方程式为 。向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH接近 时,TiO(OH)2已沉淀完全。
(3)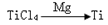 反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
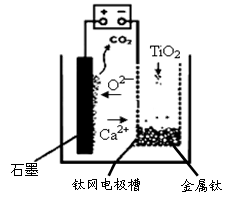
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。写出阳极上所发生的反应式: 。
参考答案:(1)Al2O3+2OH-=2AlO2-+H2O (2分);SiO2+2OH-=SiO32-+H2O (2分)
(2)①将Fe3+转化为Fe2+(1分)防止Fe3+与TiO同时生成沉淀(1分) ②TiO2++2H2O=TiO(OH)2+2H+③(2分)调节溶液pH值(1分)促进TiO2+水解(1分)3(2分)
(3)1412(2分)2O2—-4e-=O2↑(1分) C+O2=CO2(1分)或C+2O2—-4e-=CO2↑(2分)
本题解析:钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)当向其中加入NaOH溶液时,Al2O3、SiO2会发生反应,离子方程式是:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O;(2)①得到的精矿中含有FeTiO3,FeO,然后向其中加入浓硫酸,发生反应:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O;4H2SO4(浓)+2FeO=Fe2(SO4)3+SO2↑+4H2O,得到含有H+、Fe2+、Fe3+、TiO2+的溶液,步骤Ⅲ加入铁屑原因会发生反应:2Fe3++Fe=3Fe2+;防止Fe3+与TiO同时生成沉淀;② TiO2+水解的离子方程式为TiO2++2H2O=TiO(OH)2+2H+;向溶液II中加入Na2CO3粉末的作用是消耗溶液中的H+,调节溶液pH值;根据图像可知,当溶液pH接近3时,TiO(OH)2已沉淀完全;(3)TiCl4在隔绝空气时加入Mg发生置换反应产生Ti、MgCl2,同时还有过量的金属Mg,根据混合物中Mg、Ti、MgCl2的熔沸点关系可知当加热的温度略高于1412℃时,Mg、MgCl2变为气体逸出;而Ti则恰好刚刚熔化,因此可以达到分离提纯的目的。(4)由于用惰性电极石墨电极作阳极,所以电解质中的阴离子在阳极放电,该电极的电极式是:2O2—-4e-=O2↑;C+O2=CO2;或写为:C+2O2—-4e-=CO2↑。
考点:考查铁、铝、硅的化合物的性质、盐的水解、反应条件的控制、离子方程式的书写、电解原理在物质制取中的应用的知识。
本题难度:困难