微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)如图所示:已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
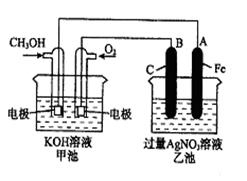
(1)请回答图中甲、乙两池的名称。甲池是 装置,乙池是 装置。
(2)B(石墨)电极的名称是 。在图中标明电子移动的方向。
(3)通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
参考答案:(14分)(1)原电池(化学能转变成电能) 电解池(电能转变成化学能)(2)阳极
(3)O2+2H2O+4e-=4OH-
(4)4AgNO3+2H2O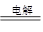 4Ag+4HNO3+O2↑ (5)280
4Ag+4HNO3+O2↑ (5)280
本题解析:(1)根据装置可知,甲是原电池,乙是电解池。
(2)原电池中负极失去电子,正极得到电子。所以甲中通入甲醇的是负极,通入氧气的是正极。则B是阳极。电子从原电池的负极经导线传递到电解池的阴极,从电解池的阳极经导线传递到原电池的正极。
(3)氧气得到电子,电极反应式为O2+2H2O+4e-=4OH-。
(4)乙中阴极氢离子放电生成氢气,阳极是银离子放电生成银,所以总反应式为
4AgNO3+2H2O 4Ag+4HNO3+O2↑。
4Ag+4HNO3+O2↑。
(5)铁电极形成的是银,物质的量是5.40g÷108g.mol=0.05mol,转移电子是0.05mol,所以根据电子得失守恒可知,消耗氧气是0.05mol÷4=0.0125mol,标准状况下的体积是0.0125mol×22.4L/mol=0.280L=280ml。
本题难度:一般
2、填空题 (13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
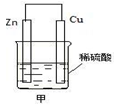
如图甲是将 能转化为 能的装置,负极电极反应式为 ,发生______反应(填“氧化”或“还原”,下同)。正极现象 ,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出 g 氢气。
参考答案:(1)吸收能量,释放能量。
(2)化学,电负极电极反应式为Zn-2e-=Zn2+,发生氧化反应,正极现象产生气泡,发生还原反应,锌片,铜片,2g
本题解析:锌铜原电池反应中,负极失去电子,经导线流向正极,被氧化:Zn-2e-=Zn2+;正极得电子,被还原:2H++2e-=H2↑;
本题难度:一般
3、选择题 下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100mL,放置一段时间后,有关叙述不正确的是(不考虑溶液体
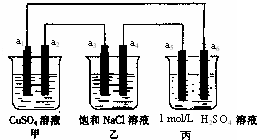
积变化)( )
A.a2电极上有亮红色固体
B.a1、a3电极上产生的物质,物质的量比是1:2
C.丙中的SO42-向a6电极移动
D.当装置电路中有6.02×1021个电子通过时,乙中溶液的pH是13
参考答案:丙装置中能自发的进行氧化还原反应,符合原电池的构成条件,甲和乙装置不能自发的进行氧化还原反应,所以丙是原电池,甲和乙有外接电源,所以构成电解池.
A、钾装置中a1是阳极,a2是阴极,阴极上铜离子放电析出铜单质,所以有亮红色物质生成,故A正确.
B、a1、a3电极上产生的物质分别是氧气、氯气,生成一个氧气分子需要氢氧根离子失去4个电子,生成一个氯气分子需要2个氯离子失去2个电子,根据失电子个数相等知,生成氧气和氯气的物质的量之比为1:2,故B正确.
C、丙装置中,铁作负极,石墨作正极,原电池放电时,溶液中阴离子向负极移动,即向a5移动,故C错误.
D、乙装置中阴极上氢离子放电,阳极上氯离子放电,电池反应式为
2NaCl+2H2O?电解?.? Cl2↑+H2↑+2NaOH 转移电子
? 2mol? 2×6.02×1023
?0.01mol? ?6.02×1021
生成氢氧化钠的物质的量是0.01mol,氢氧化钠的物质的量浓度是0.1mol/L,所以溶液的PH=13,故D正确.
故选C
本题解析:
本题难度:简单
4、填空题 (12分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。
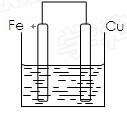
(1)铁片上的电极反应式为?,铜片上的电极反应式为?,铜片周围溶液会出现?的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为??mo1,该段时间内用硫酸铜表示的平均反应速率为?。
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入?(填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是?mo1/min。(以上均假设反应过程中溶液体积不变)。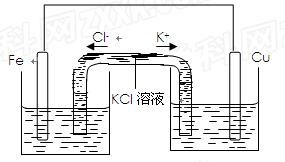
参考答案:(12分)
(1)Fe-2e-= Fe2+(2分)?Cu2++2e-= Cu(2分)颜色变浅(2分)
(2)0.02?(2分)? 0.01 mol·L-1·min-1 (2分)
(3)右侧(1分)? 0.05?(1分)
本题解析:略
本题难度:一般
5、选择题 全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:V3++VO2++H2O

VO2++2H++V2+.下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.放电过程中,H+由正极移向负极
参考答案:A、原电池放电时,VO2+离子化合价降低,被还原,应是电源的正极反应,生成VO2+离子,反应的方程式为VO2++2H++e-=VO2++H2O,故A正确;
B、放电时氧化剂为VO2+离子,在正极上被还原后生成VO2+离子,每转移2mol电子时,消耗2mol氧化剂,故B错误;
C、原电池放电时,电子由负极经外电路移向正极,内电路由溶液中离子的定向移动形成闭合回路,故C错误;
D、电解质溶液中阳离子向正极移动,阴离子向负极移动,故D错误.
故选A.
本题解析:
本题难度:一般