|
高考化学知识点总结《气体的净化、干燥、吸收与收集》考点预测(2017年强化版)(四)
2017-08-26 01:24:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (1)下图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是?_?(填代号)。

①亚硫酸钠和硫酸②二氧化锰和浓盐酸③浓氨水和生石灰④石灰石和稀硫酸⑤锌和稀硫酸⑥硫化亚铁与稀硫酸⑦双氧水和二氧化锰
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是_______(填代号)。?
A.氢氧化钠溶液
B.甲基橙溶液
C.稀盐酸
D.澄清石灰水
| ②除上述方法外,你认为是否还有其它的方法,具体如何操作_______。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是?,其理由是
?。?
②以下是除去SO42-的实验方案。
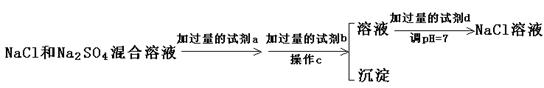
过量的a试剂是?,C操作中所使用的玻璃仪器的名称是?,证明SO42-已经沉淀完全的方法是? ?。 ?。
参考答案:(12分)
(1)①⑦
(2)①C?②用pH试纸分别测定两溶液的pH (其他合理答案均可)?
(3)①加热;因加热操作方便、简单,试剂节省且又不引入新的杂质;加盐酸看是否有气泡或加消石灰加热,用湿润的红色石蕊试纸鉴别(其他合理答案均可)?
②BaCl2;Na2CO3;过滤;盐酸;漏斗、玻璃杯、烧杯;取pH=7的溶液加BaCl2?后看是否有白色沉淀生成。
本题解析:略
本题难度:一般
2、实验题 (12分)今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液。配制过程如下图所示:
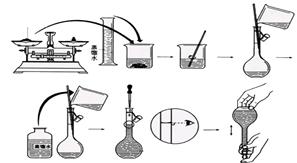
请根据题意回答:
(1)配制该溶液应选用?(填仪器)。
(2)用______(填滤纸或小烧杯)在托盘天平上称取_____ NaOH固体。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应?。
(4)配制好的溶液?(填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是??
A.容量来源:91考试网 91Exam.org瓶中原来有少量蒸馏水
B.定容时观察液面俯视
C.忘记洗涤
D.定容时观察液面仰视
参考答案:(1)100 mL容量瓶(只答?容量瓶给一分)?
(2)小烧杯、2g(只填数据0分)
(3)重做?(4)不能?(5)CD(少一个得1分,错一个得0分)
本题解析:考查一定物质的量浓度溶液的配制。
(1)准确配制100mL 0.5mol/L的NaOH溶液,应该选择100ml容量瓶。
(2)100mL 0.5mol/L的NaOH溶液中含有氢氧化钠是0.1L×0.5mol/L=0.05mol,质量是m=0.05mol×40g/mol=2.0g。又因为氢氧化钠具有吸水性和腐蚀性,因此称量时应该放在小烧杯中。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,则只能是重新配制。
(4)容量瓶不能长时间盛放溶液,因此配制完之后,必须及时转移到相应的试剂瓶中。
(5)根据 可知,容量瓶中原来有少量蒸馏水,对结果是无影响的。定容时观察液面俯视,则容量瓶中溶液的体积偏少,浓度偏大,则选项D就偏低。忘记洗涤,则溶质的物质的量偏少,浓度偏低,答案选CD。 可知,容量瓶中原来有少量蒸馏水,对结果是无影响的。定容时观察液面俯视,则容量瓶中溶液的体积偏少,浓度偏大,则选项D就偏低。忘记洗涤,则溶质的物质的量偏少,浓度偏低,答案选CD。
本题难度:一般
3、填空题 某次实验需用480 mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4 (ρ="1.84" g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ="1.84" g/cm3)的物质的量浓度为?
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到?mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温?
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用?加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为?(填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中?
②量取浓硫酸所用量筒有蒸馏水?
③定容时,俯视液面?
参考答案:(1)? 18.4mol/L??(2) ②? 500??⑤?胶头滴管?
(3)①③④②⑦⑤⑥?(4) ①偏低;?②偏低?;?③?偏高?。
本题解析:略
本题难度:简单
4、实验题 (12分)二氯化硫(SCl2)熔点—78oC,沸点59 oC,密度1.638g/cm3,遇水易分解,以下是由氯气与硫反应合成二氯化硫的实验装置,其中F中装有无水CaCl2固体。

试回答下列问题:
(1)装置A中发生反应的化学方程式为:? ? ?
(2)装置C中盛放的试剂是?,装置F的作用为?
(3)实验开始前先排尽系统中空气,此做法目的是?
再向D中放入一定量的硫粉,加热使之融化,然后摇动烧瓶使硫附着在烧瓶内壁形成一薄层膜,这样做的目的是?
(4)实验时,如何防止E中液体挥发?
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置
参考答案:(12分)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O?(2分) MnCl2+Cl2↑+2H2O?(2分)
(2)浓硫酸?防水从后面进入E使二氯化硫分解(各2分)
(3)防止加热硫粉时,空气中的氧气与硫粉反应;?增大接触面积以加快反应速率。(各1分)
(4)将锥形瓶放入冰水中冷却(2分)
(5) ?(加有安全瓶等不扣分)(2分) ?(加有安全瓶等不扣分)(2分)
本题解析:略
本题难度:一般
5、选择题 下面关于下图所示实验装置的使用方法中叙述正确的是

[? ]
①用于排水集气:充满水,B进气,A排放水
②用于收集密度比空气大的气体:B进气,A排放空气
③用于收集密度比空气小的气体:B进气,A排放空气
④用于洗气:装入洗液,A进气,B出气
A.全正确
B.②③④
C.①②④
D.①③④
参考答案:D
本题解析:
本题难度:一般
| 
 ?。
?。