微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题  是一种食品添加剂,它与酸性
是一种食品添加剂,它与酸性 溶液的反应方程式为:
溶液的反应方程式为:
 ,下列叙述中正确的是
,下列叙述中正确的是
A.生成l mo1 需消耗0.4mo1
需消耗0.4mo1
B.反应过程中溶液的pH减小
C.该反应中NO 被还原
被还原
D.X表示的粒子是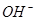
参考答案:A
本题解析:A、根据氧化还原反应得失电子总数相等的原理可得:2n(NaNO3)=5n(KMnO4),可得KMnO4为0.4mol,正确;B、根据原子守恒和电荷守恒可知X为H+,消耗H+,溶液的pH增大,错误;C、NO2-中N元素化合价升高,被氧化,错误;D、X为H+,错误。
本题难度:一般
2、选择题 下列离子方程式正确的是(?)
A.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO3-= 3Fe2++2NO↑+4H2O
B.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O
C.NH4HCO3溶液与足量KOH浓溶液共热:NH4++OH-  NH3↑+H2O
NH3↑+H2O
D.Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O
参考答案:B
本题解析:A、硝酸足量,铁元素最终被氧化为Fe3+;B、HSO4—在水溶液中完全电离可以作强酸使用;C、氢氧化钠足量,NH4+?和HCO3—都参与了反应;D、Fe3+可以将I—氧化。
本题难度:一般
3、填空题 (16分)石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
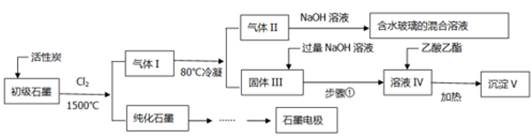
(注:SiCl4的沸点是57.6?C,金属氯化物的沸点均高于150?C)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是?。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为?。由气体II中某物质得到水玻璃的化学方程式为?。
(3)步骤①为:搅拌、?。所得溶液IV中阴离子有?。
(4)由溶液IV生成沉淀V的总反应的离子方程式为?。100kg初级石墨最多可获得V的质量为kg?。
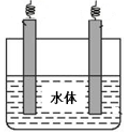
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。
参考答案:(1)排除空气,减少C的损失;
(2)SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O;
(3)过滤;Cl-、OH-、AlO2?;
(4)CH3COOCH2CH3+AlO2?+ 2H2O  ?Al(OH)3↓+CH3COO-+ CH3 CH2OH;78
?Al(OH)3↓+CH3COO-+ CH3 CH2OH;78
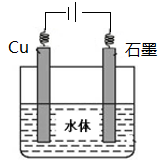
(5)
本题解析:(1)石墨的化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入N2目的是作保护气,排除空气中的氧气,减少C的损失;
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。根据杂质的含量,气体I中的氯化物主要SiCl4、AlCl3、FeCl3;SiCl4的沸点是57.6?C,所以气体II为SiCl4,与氢氧化钠溶液反应生成硅酸钠和氯化钠,化学方程式为SiCl4+6NaOH =Na2SiO3+4NaCl+3H2O;
(3)金属氯化物的沸点均高于150?C,所以固体III中存在氯化铝、氯化铁、氯化镁,其中氯化铁、氯化镁与过量氢氧化钠溶液反应生成沉淀,而氯化铝与过量氢氧化钠溶液反应生成偏铝酸钠,所以搅拌后过滤,所得溶液IV中阴离子有Cl-、OH-、AlO2?;
(4)偏铝酸钠发生水解反应,加入乙酸乙酯的目的是除去过量的氢氧化钠且加热条件下水解平衡一直正向移动,生成沉淀氢氧化铝,总离子方程式为
 CH3COOCH2CH3+AlO2?+ 2H2O? Al(OH)3↓+CH3COO-+ CH3 CH2OH;1000kg石墨中含有Al2O351kg,根据元素守恒,可得到Al(OH)3的质量是78kg。
CH3COOCH2CH3+AlO2?+ 2H2O? Al(OH)3↓+CH3COO-+ CH3 CH2OH;1000kg石墨中含有Al2O351kg,根据元素守恒,可得到Al(OH)3的质量是78kg。
(5)铜的化学性质比石墨活泼,所以应用外加电流的阴极保护法保护铜,所以石墨作阳极,铜作阴极。在图中注明电源的正负极,石墨与正极相连,铜与负极相连。

本题难度:一般
4、选择题 某实验室合成了一种可溶的金属氯化物(RClx),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05mol?L-1的金属氯化物(RClx)?溶液20mL,使之恰好与20mL?0.15mol?L-1的AgNO3溶液完全反应.则该氯化物的化学式为( )
A.RCl
B.RCl2
C.RCl3
D.RCl4
参考答案:n(Ag+)=0.02L×0.15mol/L=0.003mol,
? Ag++Cl-=AgCl↓
? 1? 1
0.003mol?n(Cl-)
n(Cl-)=0.003mol,
又n(RClx)=0.02L×0.05mol=0.001mol,
则x=n(Cl-)n(RClx)=0.003mol0.001mol=3,
所以化学式为RCl3,
故选C.
本题解析:
本题难度:简单
5、选择题 下列离子方程式正确的是( )
A.Fe粉加入稀盐酸中:2?Fe+6?H+═2Fe3++3?H2↑
B.金属钠投到水中:Na+H2O═Na++OH-+H2↑
C.石灰石投入到稀盐酸中:CO32-+2?H+═CO2↑+H2O
D.氢氧化钠溶液加入到稀硫酸中:OH-+OH+═H2O
参考答案:A.Fe粉加入稀盐酸中的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.金属钠投到水中的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.石灰石投入到稀盐酸中的离子反应为CaCO3+2H+═CO2↑+H2O+Ca2+,故C错误;
D.氢氧化钠溶液加入到稀硫酸为强碱与强酸反应生成可溶性盐和水的反应,离子反应为OH-+OH+═H2O,故D正确;
故选D.
本题解析:
本题难度:简单