|
高考化学试题《盐类水解的原理》考点巩固(2017年最新版)(四)
2017-08-26 01:46:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
[? ]
A.Cl2和SO2的漂白原理不同,混合使用效果更好
B.测定等浓度的CH3COONa和NaCN溶液的pH分别为8.8和11.1,可以判断反应CH3COOH+NaCN→CH3COONa+HCN不能发生
C.溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,则溶液中一定存在SO42-
D.若通入Cl2后,溶液变为黄色,加入淀粉溶液后变蓝色,可确定溶液中含有I-
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列图示与对应的叙述一定正确的是

A.图1所示反应:X(g)+Y(g) 2Z(g),b的压强一定比a大 2Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化
D.图4表示明矾溶液受热时氢氧根浓度随温度的变化
|
参考答案:B
本题解析:A.图1所示反应:X(g)+Y(g) 2Z(g),b比a反应速率快,可能是增大压强,也可能是加入了催化剂。错误;B.图2表明合成氨反应是放热反应,b表示的是活化能比原来小,应该是表示在反应体系中加入了催化剂,正确;C.向Ca(HCO3)2溶液中滴入NaOH溶液,发生反应:Ca(HCO3)2+ 2NaOH =CaCO3↓+H2O+Na2CO3,因此立刻产生白色沉淀,故图示不能产生的沉淀的质量变化的情况,错误;D.明矾溶液受热时发生水解反应产生Al(OH)3,使c(OH-)减小,故不能表示氢氧根浓度随温度的变化,错误。 2Z(g),b比a反应速率快,可能是增大压强,也可能是加入了催化剂。错误;B.图2表明合成氨反应是放热反应,b表示的是活化能比原来小,应该是表示在反应体系中加入了催化剂,正确;C.向Ca(HCO3)2溶液中滴入NaOH溶液,发生反应:Ca(HCO3)2+ 2NaOH =CaCO3↓+H2O+Na2CO3,因此立刻产生白色沉淀,故图示不能产生的沉淀的质量变化的情况,错误;D.明矾溶液受热时发生水解反应产生Al(OH)3,使c(OH-)减小,故不能表示氢氧根浓度随温度的变化,错误。
考点:考查图示法在表示化学反应中的应用的知识。
本题难度:一般
3、选择题 下列有关溶液中微粒的物质的量浓度关系正确的是
A.某酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合:c(CN-)+2c(OH-)=2c(H+)+c(HCN)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中: c(NH4+)+ c(NH3·H2O) + c(Fe2+)="0.3" mol·L-1
参考答案:BC
本题解析:c(OH-)+c(A2-)=c(H+)+c(H2A),A错误。0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后 CH3COONa 过量,c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B正确。质子守恒c(CN-)+2c(OH-)=2c(H+)+c(HCN),C正确。0.1mol·L-1(NH4)2Fe(SO4)2溶液中NH4+水解亚铁离子水解,D错误。
本题难度:简单
4、填空题 (16分)物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.01mol/L的NH4Cl溶液中各种离子的浓度由大到小顺序为 ;电荷守恒关系: ;浓度为0.01mol/L的是 ; 和 两种粒子的浓度之和是0.01mol/L。
(2 )CH3COONa溶液中存在的2个平衡体系分别为(分别用离子方程式表示): 、 ;
(3) FeCl3溶液与Na2CO3溶液混合后,反应的离子方程式为 .
参考答案: (1)c(Cl-)>c(NH4+)>c(H+)>c(OH-) , c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) , Cl-, NH4+ NH3.H2O
(2)CH3COO-+H2O CH3COOH+OH-, H2O CH3COOH+OH-, H2O H++OH- H++OH-
(3)2Fe3++3CO32-=2Fe(OH)3↓+3CO2↑
本题解析:(1)氯化铵水解显酸性,但水解程度还是很弱的,所以离子的浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。满足电荷守恒的关系是c(H+)+ c(NH4+)= c(Cl-)+ c(OH-)。根据氮原子守恒可知NH4+和NH3.H2O两种粒子的浓度之和是0.01mol/L。因为氯离子不水解,所以氯离子的浓度也是0.01mol.L的。
(2)水溶液中一定有水的电离平衡。醋酸钠水解显碱性,所以还存在水解平衡。
(3)氯化铁水解显酸性,碳酸钠水解显碱性,所以二者的混合液水解相互促进,使水解完全,生成氢氧化铁沉淀,放出CO2气体。
本题难度:困难
5、填空题 (12分) .
(1)稀释0.1 mol·L-1氨水时,随着水量的增加而减小的是 (填写序号)。
① ② ②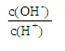 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需的时间B>A
②开始反应时的速率A>B
③参加反应的锌粉物质的量A=B
④反应过程中的平均速率B>A
⑤A溶液里有锌粉剩余
⑥B溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的_________曲线(填写序号) 。
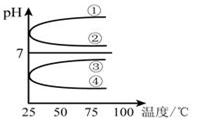
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______________ 。
(5)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。
参考答案:(1)①② ; (2)③④ ⑤; (3)④ ;(4)c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ;(5)中 ;
本题解析:(1))稀释0.1mol·L-1氨水时 ,①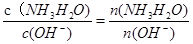 ,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb= ,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb= = = 答案为 答案为
考点:电荷守恒、盐类的水解
本题难度:困难
|