微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知某一硅酸盐可表示为Mg?a(Si4O10)(OH)b(其中a、b为正整数).试问:
(1)a与b应满足的关系______?(填写表达式)
(2)a能否等于2______?(选填“能”、“不能”、“无法确定”)
(3)写出a=4时硅酸盐的表达式______.(以氧化物的形式表示)
参考答案:(1)硅酸盐Mg?a(Si4O10)(OH)b以氧化物的形式表示为aMgO.4SiO2.b2H2O,共用O原子守恒得:
a+8+b2=10+b,化简后得2a=b+4,故答案为2a=b+4.
(2)2a=b+4,且a、b都大于0,当a=2时,b=0,所以错误.
故答案为:不能.
(3)当a=4时,b=4,所以该硅酸盐的化学式为4MgO?4SiO2?2H2O(以氧化物的形式表示).
故答案为:4MgO?4SiO2?2H2O.
本题解析:
本题难度:一般
2、填空题 (12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
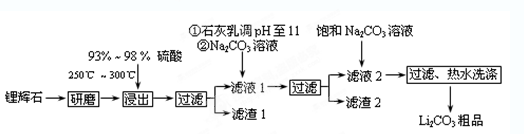
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓)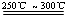 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
T/℃
| 20
| 40
| 60
| 80
|
S(Li2CO3)/g
| 1.33
| 1.17
| 1.01
| 0.85
|
S(Li2SO4)/g
| 34.2
| 32.8
| 31.9
| 30.7
|
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。
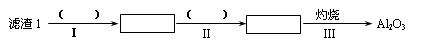
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是? ?。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
②b中,生成Li2CO3反应的化学方程式是______________________________。
参考答案:(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+?
(2) 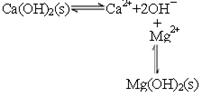 平衡右移,沉淀转变为Mg(OH)2?
平衡右移,沉淀转变为Mg(OH)2?
Mg2++Ca(OH)2=Mg(OH)2+Ca2+
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)①2Cl――2e―=Cl2↑ ②2LiOH+NH4HCO3=Li2CO3+NH3 .H2O+H2O
本题解析:(1)滤渣I中含有氧化铝和二氧化硅,由于二者都和氢氧化钠反应,所以要除去二氧化硅,应该用盐酸溶解氧化铝。过滤后向滤液中通入氨气即生成氢氧化铝沉淀,方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(2)石灰乳中存在平衡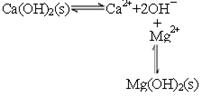 ,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg(OH)2,方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+。
,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg(OH)2,方程式为Mg2++Ca(OH)2=Mg(OH)2+Ca2+。
(3)由于Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失。
(4)①由于电解池中阳极失去电子,所以溶液中的氯离子在阳极放电,方程式为2Cl――2e―=Cl2↑。
②根据反应物和生成物可以写出反应的方程式为2LiOH+NH4HCO3=Li2CO3+NH3 .H2O+H2O 。
本题难度:一般
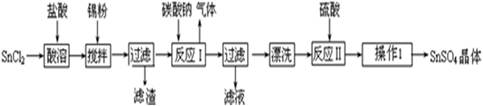
3、填空题 硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第?周期(1分)
(2)操作Ⅰ是 ?过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是??
(4)加入Sn粉的作用有两个:①调节溶液pH?②?
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是?
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是?
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 +?K2Cr2O7 +?HCl = ?FeCl3 + ?KCl + ?CrCl2+?
参考答案:32.(16分)(1)第五周期(1分);?(2)蒸发浓缩、冷却结晶(2分);
(3)?抑制Sn2+ 的水解(2分);?(4)防止Sn2+ 被氧化(2分);
(5)SnCl2 + Na2CO3=" SnO↓+" CO2↑+ 2NaCl(3分,未写↓和↑符号共扣1分,未配平扣1分)
(6)Sn2+ + H2O2 +2H+ = Sn4 + + 2H2O (3分,未配平扣1分)
(7)③ 6? 1? 14? 6? 2? 2? 7 H2O(3分,化学式H2O给1分,系数全对2分)
本题解析:
试题分析: 解:(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期。
(2)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到。
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在水解平衡SnCl2+H2O Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解。
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解。
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;?
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,反应方程式为:SnCl2 + Na2CO3=" SnO↓+" CO2↑+ 2NaCl。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O。
(7)反应物中有H元素,所以在酸性条件下生成物必为H2O,所以根据的是电子守恒配平的方程式为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
本题难度:困难
4、选择题 对下列材料的特性及用途的说法不正确的是
[? ]
A、玻璃纤维柔软如丝,可像棉纱一样纺织,但拉伸强度低
B、光导纤维传导光的能力很强,是非常好的通讯材料
C、玻璃钢强度高,密度小、但不耐腐蚀,所以不能用于制造废水处理系统的管道
D、氮化硅陶瓷耐高温且不易传热,可用于制造柴油机
参考答案:AC
本题解析:
本题难度:简单
5、选择题 下列有关海水综合利用的说法不正确是
A.可用蒸馏或离子交换等方法淡化海水
B.海水提溴只涉及物理变化
C.利用海水可以制取金属Mg
D.开发海洋资源不能以牺牲环境为代价
参考答案:B
本题解析:海水中盐的沸点高,水的沸点较低,因此可以用蒸馏海水的方法制取蒸馏水,也可以用离子交换的方法除去海水中的阴阳离子,制取淡水,A项正确;海水中溴元素以-1价形式存在,Br2中溴元素以0价形式存在,则海水提溴一定有新物质生成,一定涉及化学变化或氧化还原反应,B项不正确;海水中含有+2价的镁元素,通过分离提纯可以制备无水MgCl2固体,由于镁是活泼金属,可以用电解熔融MgCl2的方法制取单质镁和氯气,C项正确;开发海洋资源时要保护环境,不能破坏环境,D项正确。
本题难度:简单