微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
?
| NaOH起始读数
| NaOH终点读数
|
第一次
| 0.40mL
| 18.50mL
|
第二次
| 1.30mL
| 18.05mL
|
第三次
| 3.10mL
| 21.20mL
|
?(1)达到滴定终点的时溶液颜色的变化为? ?色到?色;
?色到?色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为?;
(3)以下操作造成测定结果偏高的原因可能是?。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
参考答案:(1)?无?(浅)红?(2)? 0.1448 mol/L?(3)CD
本题解析:略
本题难度:一般
2、实验题 某化学小组以苯甲酸为原料制取苯甲酸甲酯,并用制得的苯甲酸甲酯进行碱性水解的实验。
I.制取苯甲酸甲酯:已知有关物质的沸点如下表:
物质
| 甲醇
| 苯甲酸
| 苯甲酸甲酯
|
沸点/℃
| 64.7
| 249
| 199.6
|
实验装置如下:

(1)简述第一步混合液体时,最后加入浓硫酸的理由是
?。
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:
?。
(2)分液时上层液体从?出来;接受馏分时温度控制在?。
(3)此制取过程比教材中乙酸乙酯的制备复杂很多,写出用此过程制备苯甲酸甲酯的两大优点:?、?。
II、苯甲酸甲酯碱性水解
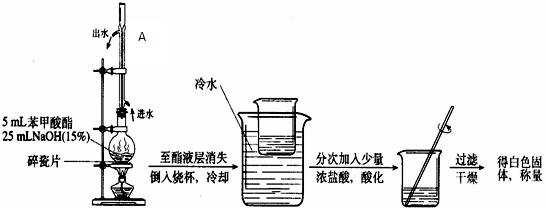
(4)写出苯甲酸甲酯碱性水解的化学反应方程式?。
(5)写出苯甲酸甲酯碱性水解实验装置中A的作用?。
III、苯甲酸甲酯有多种同分异构体
(6)符合下列条件的结构
①可以发生银镜反应②属于芳香族化合物③不具备其它环状结构④不能与FeCl3发生显色反应;共有?种。
参考答案:(16分)(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发;(2分)? C6H5CO18OH+CH3OH C6H5COOCH3+H218O 。(2分)
C6H5COOCH3+H218O 。(2分)
(2)分液漏斗的上口;199.6℃左右。(各2分)(3)产率高;纯度高。(2分)
(4)C6H5COOCH3 + NaOH? →?C6H5COONa + CH3OH。(2分)
(5)冷凝回流。(2分) (6)12? (2分)
本题解析:I(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,为确保实验的安全所以采用最后加入浓硫酸,再加上甲醇的沸点低易挥发;
酯化反应的特点是:酸脱羟基醇脱氢,所以其反应机理为:
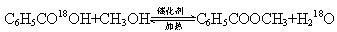
(2)分液时,上层液体应从分流漏斗的上口倒出,下层液体应从分流漏斗的下口倒出。
根据苯甲酸甲酯的沸点可知,接受馏分时温度控制在199.6℃左右
(3)这样操作可以使反应物尽可能多的转化为生成物,使反应物得到充分反应,且生成的产物更纯。
II:(4)酯的水解反应是酯化反应的逆反应,且酯在碱性条件下水解较彻底
C6H5COOCH3 + NaOH? →?C6H5COONa + CH3OH
(5)该装置中冷管的作用为冷凝回流
III(6)共12种,如下图所示
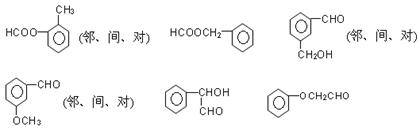
能发生银镜反应的物质有:醛类、甲酸、甲酸某酯、甲酸盐、还原性糖等。
本题难度:简单
3、选择题 下列实验装置正确且能达到相应的实验目的的是?

A.制取SO2并检验SO2的漂白性
B.测定盐酸浓度检验
C.从食盐水中提取NaCl
D.合成氨并氨的生成
参考答案:A
本题解析:略
本题难度:一般
4、简答题 亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
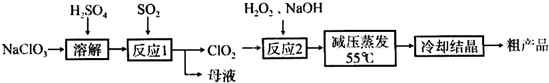
(1)提高“反应1”反应速率的措施有______、______等.
(2)“反应2”的氧化剂是______,该反应的化学方程式为:______.
(3)采取“减压蒸发”而不用“常压蒸发”,原因是______.
(4)从“母液”中可回收的主要物质是______.
(5)“冷却结晶”后经______(填操作名称)即可获得粗产品.
参考答案:(1)对伊气体和液体的反应,为提高反应速率,可适当升高反应温度;增大吸收液浓度,增大SO2与吸收液的接触面积,
故答案为:适当升高反应温度;增大吸收液浓度等;
(2)具有氧化性,根据生成NaClO2目标物的特点可知,反应的方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,反应中Cl元素的化合价降低,则ClO2为氧化剂,
故答案为:ClO2;H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;
(3)减压蒸发在较低温度下可进行,防止常压蒸发温度过高,亚硫酸钠容易分解,
故答案为:常压蒸发温度过高,亚硫酸钠容易分解;
(4)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4,
故答案为:Na2SO4;
(5)冷却结晶后要分离出固体,应用过滤的方法,故答案为:过滤.
本题解析:
本题难度:一般
5、实验题 (20分)工业上常利用含硫废水生产Na2S2O3?5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
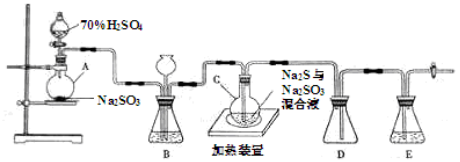
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)?(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)?(II)
S(s)+Na2SO3(aq) Na2S2O3(aq)?(III)
Na2S2O3(aq)?(III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若?,则整个装置气密性良好。装置D的作用是?
??。装置E中为?溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为?。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择?。
a.蒸馏水? b.饱和Na2SO3溶液
c.饱和NaHSO3溶液? d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是?。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是?。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有?。
a.烧杯? b.蒸发皿? c.试管? d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3?5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
?。
已知Na2S2O3?5H2O遇酸易分解:S2O32?+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
参考答案:(1)液注高度保持不变;防止倒吸;NaOH(合理即得分)
(2)2:1
(3)c;控制滴加硫酸的速度(合理即得分);溶液变澄清(或浑浊消失);a、d
(4)取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。(合理即得分)
本题解析:(1)液注高度保持不变,说明气密性良好;D为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液。
(2)根据题目所给3个反应,可得出对应关系:2Na2S ~ 2H2S ~ 3S ~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小,所以c项正确;SO2为70% H2SO4与Na2SO3反应制取,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度;反应III 固体S反应,所以烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失);蒸发皿和试管可以直接加热,烧杯和锥形瓶加热时需要使用石棉网,故a、d正确。
(4)加入盐酸,Na2S2O3反应S沉淀,所以静置后取上层清液,滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。
本题难度:一般