微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。现利用如图装置制取苯甲酸甲酯粗产品,再测定苯甲酸甲酯的含量。
实验一:制取苯甲酸甲酯
在圆底烧瓶中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A(用酒精灯加热略)连接仪器并实验。
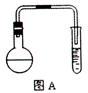
(1)苯甲酸与甲醇反应的化学方程式为?。
(2)要想提高苯甲酸的转化率,可以采取的措施是?。
实验二:为测定苯甲酸甲酯的含量,进行了如下操作:
(I)准确称量30.0g苯甲酸甲酯粗品于锥形瓶中,用0.50mol/L 滴定(酚酞做指示剂)。终点时消耗
滴定(酚酞做指示剂)。终点时消耗 溶液的体积为40.0mL;
溶液的体积为40.0mL;
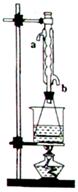
(II)另取30.0g苯甲酸甲酯粗产品于250ml锥形瓶中,加入100ml2.1mol/L 溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L
溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L 滴定过量的
滴定过量的 。终点时消耗盐酸的体积为20.0ml。回答:
。终点时消耗盐酸的体积为20.0ml。回答:
(3)实验(I)中达到滴定终点时的现象是?
(4)实验(II)中冷水从冷水凝管的?(填a或b)管口通入。
(5)利用实验(I)、(II)测量的数据计算粗产物中苯甲酸甲酯的质量分数为?。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,需要测量的实验数据是?。
参考答案:(1)
(2)加入过量的甲醇,移去苯甲酸甲酯
(3)溶液由无色恰好变为浅红色,并在半分钟内不褪色
(4)b
(5)81.6%
(6)试管中生成相同厚度的有机层所需的时间
本题解析:略
本题难度:简单
2、实验题 现有3瓶没有标签的无色溶液,它们分别是NaHCO3、Ba(OH)2、H2SO4
中的各一种,某研究性学习小组探究“不用其它试剂即可鉴别”的方法。将试剂瓶分别编号为①、②、③。
⑴甲同学采用如下实验方案:
分别取样进行分组实验,现象如下表所示:
?
根据实验现象得出结论:②试剂为?。
甲同学又做如下两个实验,鉴别①和③
 ?
?
请分析甲同学实验失败的可能原因:?。
⑵乙同学采用如下实验方案:
乙同学采用甲同学同样的实验过程,鉴别出其中的②后,又做如下实验:

请分析乙同学实验失败的可能原因:?。
⑶丙同学采用如下实验方案:
丙同学采用甲同学同样的实验过程,鉴别出其中的②后,又做如下实验:
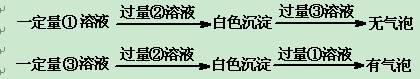
根据实验现象得出结论:①试剂为?,③试剂为?。
⑷丁同学参与甲、乙、丙三位同学的实验过程,发现当采用分组实验鉴别出②后,无需再进行任何实验操作,立即就可区分出另外两瓶试剂,他的方法是?。
参考答案:⑴Ba(OH)2(2分),因为当Ba(OH)2加少了,最后反滴的①或③多了,所以均有气体生成(3分)。
⑵生成的水太少,放出的热太少。(或Ba(OH)2的溶解度较小,溶液太稀,中和放出热量较少)(3分)
⑶H2SO4(2分)、NaHCO3(2分)
⑷观察①、③试剂瓶的瓶塞,胶塞的为NaHCO3,玻璃塞的为H2SO4(3分)。
本题解析:略
本题难度:一般
3、实验题 兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。

①实验I、Ⅱ的目的是____________。
②实验Ⅲ中反应的本质是(用离子方程式表示)____________________。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
①Cu作_______极。②总反应的离子方程式是________________。
参考答案:(1)①证明Cu不与H+、NO3-单独反应;②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①阳;②Cu+2H+ Cu2++H2↑
Cu2++H2↑
本题解析:
本题难度:一般
4、实验题 (20分)某研究性学习小组在实验室中配制0.20mol·L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液。
⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有?﹑?。
⑵滴定:
①盛装0.20mol·L-1盐酸标准液应该用?式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到?时为滴定终点。
③有关数据记录如下:
滴定序号
| 待测液体体积(mL)
| 所耗盐酸标准液的体积(mL)
|
起始读数
滴定前
| 终点读数
|
1
| 20.00
| 0.50
| 20.40
|
2
| 20.00
| 6.00
| 26.10
|
3
| 20.00
| 4.00
| 24.00
|
?
数据处理:NaOH溶液的浓度为?mol·L-1,烧碱样品的纯度为?。(保留三位有效数字)
⑶试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果?;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果?;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果?;
④读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果?;
参考答案:(1)胶头滴管 、玻璃棒 ;?
(2) ①酸式;② 红色变成无色且半分钟不恢复;③ 0.20mol·L-1; 94.1% ;
(3) ① 无影响 ;②偏高;③ 偏低;④ 偏高。
本题解析:⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有胶头滴管、玻璃棒;⑵ ①盐酸标准液应该用酸式滴定管;②滴定时,先向锥形瓶中加酚酞作为指示剂;再逐滴滴定,由于开始时酚酞在碱性溶液中,因此滴定前溶液为红色。当观察到滴加最后一滴盐酸,溶液由红色变成无色且半分钟不恢复时滴定达到了终点。③第一次滴加消耗体积为19.90ml;第二次滴加消耗体积为:20.10ml;第三次滴加消耗体积为20.00ml.因此平衡消耗HCl的体积为:(19.90ml+20.10ml+20.00ml)÷3=20.00ml。根据酸碱恰好完全中和时二者的物质的量相等可得c(NaOH)="c(HCl)·V(HCl)/v(NaOH)=" (0.20mol/L×20.00ml) ÷20.00ml=" 0.20" mol/L。n(NaOH)=0.20mol/L×0.02L×10=0.04mol.m(NaOH)=0.04mol×40g/mol=1.6g.所以NaOH的纯度为:(1.6g÷1.7g)×100%=94.1%。⑶①若用蒸馏水冲洗锥形瓶,由于在锥形瓶中碱是物质的量不变,所以不会使测定的结果产生误差。无影响。②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则消耗的标准酸溶液的体积偏大,以此为标准会使测定结果偏高。③若刚见到指示剂局部的颜色有变化就停止滴定,则消耗的标准酸溶液的体积就偏小,以此为标准计算的结果就偏低。④读数时,若滴定前俯视读数,开始读数偏小;滴定后仰视读数,滴定终点读数偏大,以此为标准计算的结果就偏高。
本题难度:一般
5、填空题 钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位.含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下:
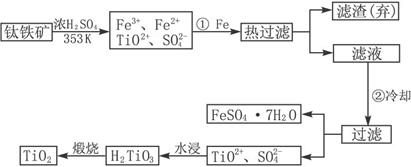
(1)Ti的原子序数为22,Ti位于元素周期表中第______周期,第______族.
(2)步骤①加Fe的目的是______;步骤②冷却的目的是______.
(3)上述制备TiO2的过程中,可以利用的副产物是______;考虑成本和废物综合利用因素,废液中应加入______处理.
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:已知:
①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=______.反应TiCl4+2Mg=2MgCl+Ti?在Ar气氛中进行的理由是______.
参考答案:(1)Ti位于元素周期表中第四周期ⅣB族,故答案为:四;ⅣB;
(2)铁粉的作用是为了除去混合溶液中的Fe3+;步骤②冷却的目的由操作过滤和得到的物质是FeSO4?7H2O可得,是为降低FeSO4?7H2O的溶解度,
故答案为:将Fe3+还原为Fe2+;析出(或分离、或得到)FeSO4?7H2O;
(3)得到的副产物为FeSO4?7H2O,图示水浸过程生成H2TiO3同时生成的H2SO4溶液(TiOSO4+2H2O=H2TiO3+H2SO4),应加入碱性物质处理,可以是石灰(或碳酸钙、废碱),
故答案为:FeSO4?7H2O;?石灰(或碳酸钙、废碱);
(4)依盖斯定律,将③+①×2-②可得:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),
△H=(+141kJ?mol-1)+2×(-393.5kJ?mol-1)-(-566kJ?mol-1)=-80 kJ?mol-1,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,
故答案为:-80?kJ?mol-1;?防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
本题解析:
本题难度:一般