微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于SiO2晶体的叙述中,正确的是 ( )。
A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B.60 g SiO2晶体中,含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子,2个氧原子
参考答案:C
本题解析:SiO2为原子晶体,晶体中不存在分子,SiO2晶体中一个Si原子与周围4个O原子形成4个Si—O键,一个O原子和两个Si原子形成2个Si—O键所以SiO2晶体中Si、O原子个数比为2:1。在SiO2晶体中一个Si原子和4个O原子构成正四面体构型。所以正确的选项是C。2晶体构型
点评:原子晶体是一个三维的共价键网状结构,不存在单个小分子,是一个“巨分子”。所以其化学式表示原子的个数比,而不是分子式。
本题难度:一般
2、简答题 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
(1)写出F元素的电子排布式______.
(2)己知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______.
(3)己知C、E两种元素合成的化合物通常有CE3、CE5两种.这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______.
(4)B、C、D、E的第一电离能由大到小的顺序是______(写元素符号).四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式).
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”.如图所示为B、E形成化合物的晶胞结图以及晶胞的剖面图,晶胞中距离一个Na+最近的Na+有______个.若晶体密度为ρg?cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径______cm(用含NA与ρ式子表达).
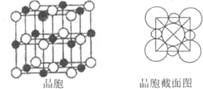
参考答案:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等,则其原子核外电子排布为1s22s22p4,则A为氧元素;B是短周期中原子半径最大的元素,则B为Na元素;C元素3p能级半充满,则其原子核外电子排布为1s22s22p63s23p3,则C为磷元素;F是第四周期未成对电子最多的元素,则F的核外电子排布为1s22s22p63s23p63d54s1,则F为Cr元素;E是所在周期电负性最大的元素,原子序数大于P小于Cu,则应处于第三周期,故E为Cl元素;D原子序数介于磷、氯之间,则D为硫元素,
(1)F为Cr元素,其原子核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(2)己知A元素的一种氢化物分子中含四个原子,该氢化物为H2O2,H2O2分子中O原子成1个O-O键、1个O-H键,含有2对孤电子对,杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;
(3)P、Cl两种元素合成的化合物通常有PCl3、PCl5两种,PCl3中P原子成3个P-Cl键、含有1对孤电子对,P原子采取sp3杂化,为三角锥型结构,不是对称结构,属于极性分子,
故答案为:三角锥型;
(4)同周期自左而右第一电离能呈增大趋势,P元素3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>Cl>S>Na,氢氧化钠为强碱,磷酸属于弱酸,高氯酸、硫酸属于强酸,二者浓度相等,硫酸中氢离子浓度大,硫酸酸性最强,故四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是NaOH>H3PO4>HClO4>H2SO4,
故答案为:P>Cl>S>Na;NaOH>H3PO4>HClO4>H2SO4;
(5)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个.晶胞中Na+离子数目=1+12×14=4,Cl-离子数目=8×18+6×12=4,故晶胞质量=4×58.5NAg,晶胞体积=4×58.5NAgρg/cm3=234ρNAcm3,令Cl-离子半径为r,则棱长为
本题解析:
本题难度:简单
3、选择题 下列晶体中的最小环不是由六个原子构成的是( )
A.金刚石
B.石墨
C.水晶
D.晶体硅
参考答案:C
本题解析:晶体硅和金刚石的微观结构相似,都是每个原子与周围的四个原子形成正四面体结构,最小的环有6个原子构成。石墨是片层结构的混合型晶体,每一层中都是由无数个正六边形并置而成。水晶可以看作是在晶体硅的每个硅硅键中插入一个氧原子所形成的,所以最小的环是十二边形。
本题难度:简单
4、选择题 下列叙述错误的是? (? )
A.含离子键的晶体一定是离子晶体
B.离子晶体一定不含共价键
C.Na2O和SiO2晶体中都不存在单个小分子
D.冰醋酸晶体与冰熔化时需要克服的粒子间作用力类型相同
参考答案:B
本题解析:A选项含离子键的晶体一定是离子晶体,B选项离子晶体中可含共价键如NaOH;C选项Na2O和SiO2晶体中微粒间个数比分别为2:1和1:2;D选项冰醋酸晶体和冰 熔化时克服的都是分子间作用力
本题难度:简单
5、填空题 根据下图回答问题:
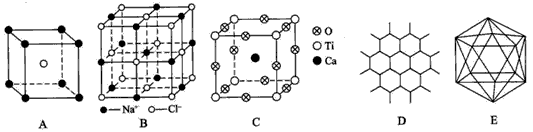
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个顶 点,该化合物中阳、阴离子的个数比是____。
(2)B图表示构成NaCl晶体的一个晶胞,通过想象与推理,可确定一个NaCl晶胞中含Na+和Cl-的个数分别为____、______。
(3)钇钡铜复合氧化物超导体有着与钙钛矿型相关的晶体结构,若Ca、Ti、O结构如C图所示的晶体,其 化学式为____。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为____,C-C键个数为____。
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如E图所示。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察E图,推断这个基本结构单元所含硼原子个数、键角、B-B键的个数依次为____、____、____。
参考答案:(1) 1:1
(2)4;4
(3) CaTiO3
(4)2;3
(5)12;60°;30
本题解析:
本题难度:一般