微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为______.
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于______晶体.
(3)SO42-和?S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是______.
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是______,原因是______.
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为______,分子的空间构型为______.
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为______.

参考答案:(1)Ti的原子序数为22,位于周期表第四周期ⅡB族,核外电子排布为[Ar]3d24s2,
故答案为:[Ar]3d24s2;
(2)两种氯化物的熔沸点较低,应属于分子晶体,故答案为:分子;?
(3)A.SO42-中只存在σ键,故A错误;
B.S2O82-中含有S-S键,为非极性键,有强氧化性,故B正确;
C.SO42-和?S2O82-中S元素的化合价分别为+6价和+7价,两者的氧元素的化合价不同,故C错误,
故答案为:B;
(4)影响离子晶体熔沸点高低的因素有半径因素和电荷因素,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高,
故答案为:MgO;均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高;?
(5)价层电子对数为6+22=4,孤电子对数为6-22=2,所以杂化类型为sp3杂化,分子为V形结构,
故答案为:sp3、V形(折线形);?
(6)图1中Fe位于体心和顶点,铁的配位数为8,图2中Fe位于顶点和面心,距离最近的为顶点和面心的铁原子,有12个,所以配位数为12,二者比值为8:12=2:3,
故答案为:2:3.
本题解析:
本题难度:一般
2、填空题 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物?。
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列?。
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为?;
(4)Se原子基态核外电子的排布式为?;H2Se的沸点:-41.1℃ ,H2S的沸点:-60.4℃,引起两者沸点差异的主要原因是?;
(5)SO32-离子中硫原子的杂化方式?,该离子的立体构型为?;
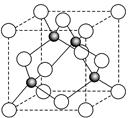
(6)某金属元素A的氧化物用作玻璃、瓷器的颜料、脱硫剂。其立方晶体的晶胞结构如右图所示,
则该氧化物的化学式为?。
参考答案:(12分)[(4)、(5)两题每空1分,其余每空2分]
(1)CS2或N2O? (2)SiO2>Na2O>P2O5? (3) O>S>Se?
(4)1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4? H2Se分子之间的作用力强于H2S?
(5) sp3;三角锥形? (6) AO
本题解析:(1)原子数和价电子数分别都相等的互为等电子体,CO2含有3个原子、4+6×2=16个价电子数,所以与CO2等电子的化合物是CS2或N2O。
(2)Na2O、SiO2、P2O5三种氧化物形成的晶体类型分别是离子晶体、原子晶体和分子晶体,所以三种氧化物按熔沸点由高到低顺序排列是SiO2>Na2O>P2O5。
(3)非金属性越强,第一电离能越大。根据元素周期律可知,同主族元素自上而下非金属性逐渐减弱,即O、S、Se三种元素的非金属性强弱顺序是O>S>Se,所以三种原子的第一电离能由大到小的顺序为O>S>Se。
(4)Se元素的原子序数是34,所以根据构造原理可知,Se原子基态核外电子的排布式为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4;由于H2Se和H2S分子形成的晶体类型均是分子晶体,而H2Se分子之间的作用力强于H2S,所以H2Se的分子沸点高于H2S的沸点。
(5)根据价层电子对互斥理论可知,SO32-离子中硫原子含有的孤对电子对数=(6+2-3×2)÷2=1,所以该离子的空间构型是三角锥形,而硫原子的杂化方式是sp3。
(6)根据晶胞结构并借助于均摊法可知,晶胞中含有的白球个数=8× +6×
+6×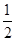 =4个,而黑球全部在晶胞内,其个数=4个,所以该氧化物的化学式是AO。
=4个,而黑球全部在晶胞内,其个数=4个,所以该氧化物的化学式是AO。
本题难度:一般
3、选择题 下列有关氯化钠晶体(下图为晶胞)的叙述中,正确的
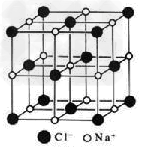
[? ]
A.在NaCl晶体中,每个Na+周围与其距离最近的Na+有6个
B.氯离子采取A2密堆积,钠离子填入八面体空隙中
C.每个晶胞含2个Na+和2个Cl-
D.氯化钠的化学式为NaCl
参考答案:D
本题解析:
本题难度:一般
4、填空题 (9分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
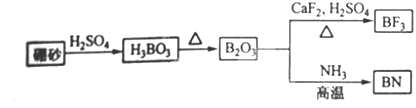
请回答下列问题:
(1)由B2O3制备BN、BF3的化学方程式依次是______?___、
___?_______;
(2)BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为____?___;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_____?_,层间作用力为____?____;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是____?___g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
参考答案:(1)B2O3+3CaF2+2H2SO4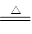 2BF3↑+3CaSO4+3H2O
2BF3↑+3CaSO4+3H2O
B2O3+2NH3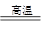 2BN+2H2O
2BN+2H2O
(2)正四面体?(1分)(3)共价键?范德华力(各1分)?
(4) (2分)
(2分)
本题解析:(1)根据反应物和生成物结合原子守恒,可以分别写出该反应的化学方程式。
(2)BF4-的中心原子没有孤对电子,所以是正四面体结构。
(3)B和N均是非金属,形成的化学键是共价键。而层与层之间则是分子间作用力。
(4)根据金刚石的结构可知,晶胞中含有的原子个数是4,所以立方氮化硼中含有的微粒个数也是4,质量为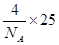 。晶胞的体积是(361.5×10-3)3,所以其密度是
。晶胞的体积是(361.5×10-3)3,所以其密度是 。
。
本题难度:一般
5、计算题 由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101 g cm?3,镁和氢的核间距为194.8 pm。已知氢原子的共价半径为37pm,Mg2+ 的离子半径为72 pm。
⑴ 写出该氢化物中氢的存在形式,并简述理由。?
⑵ 将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。?
⑶ 实验测定,上述Mg2NiH4晶体的晶胞参数为646.5 pm,计算该晶体中镁和镍的核间距。已知镁和镍的原子半径分别为159.9 pm和124.6 pm。?
⑷ 若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(假定氢可全部放出;液氢的密度为0.0708 g·cm-3)。
参考答案:⑴H-
镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵Mg原子与Ni原子数之比为2 : 1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。
镁原子的位置用下列坐标参数:
1/4, 1/4, 1/4; 1/4, 1/4, 3/4; 3/4, 3/4, 1/4; 3/4, 3/4, 3/4;
1/4, 3/4, 1/4; 1/4, 3/4, 3/4; 3/4, 1/4, 1/4; 3/4, 1/4, 3/4。
⑶镁镍间的距离为
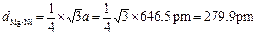 ?
?
不能用原子半径相加计算镁-镍间的距离。
⑷储氢能力=晶体的密度×氢的质量分数÷液氢密度
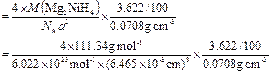 ?
?
= 1.40
=" 1.4"
本题解析:⑴镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵该晶体中,Ni原子按面心立方方式排列,该结构中原子数∶四面体空隙数∶八面体空隙数=1∶2∶1,从Ni和Mg的配位数可知,Mg填入四面体空隙中。
⑶直接利用空间中两点间的距离计算公式,计算(0,0,0)和(1/4,1/4,1/4)两点间的距离。
⑷本题的核心在于检查学生晶体密度的计算公式的掌握及熟练程度,将数据带入公式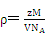 ,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
本题难度:一般