微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)实验室需用浓度为18.4 mol?L-1 浓硫酸配制3.68 mol?L-1 的稀硫酸250mL。填写下列空格。
(1)实验步骤(请补全实验操作过程):
①用量筒取浓硫酸__________mL。
②将浓硫酸慢慢注入盛有少量蒸馏水的小烧杯中,并不断搅拌。
③立刻将稀释后硫酸溶液沿玻璃棒注入容量瓶中。
④用少许蒸馏水洗涤小烧杯,将洗涤液沿玻璃棒注入容量瓶并重复_______次。
⑤继续向容量瓶内小心加蒸馏水,直至距离刻度线__________处。
⑥改用胶头滴管加蒸馏水,使液体的凹液面与刻度线相切。
⑦将容量瓶盖紧摇匀,并将所配溶液装入试剂瓶贴好标签。
上述操作有无不当之处,请指出,并加以改正:__________。
(2)实验中除用量筒、烧杯、胶头滴管、玻璃棒外,还用到的玻璃仪器有_______;
(3)若出现如下情况,对所配溶液浓度的影响是(选填“偏高”、“偏低”或“无影响”);
a.没有进行操作步骤④_______;b.开始时容量瓶没有干燥__________;
(4)其实验过程中出现如下情况应如何处理?
a.定容时加蒸馏水不慎超过了刻度线____________;
b.向容量瓶中转移溶液时(步骤②)不慎有液滴掉在容量瓶外面___________。
参考答案:(1)①50mL。?④重复2~3次。?⑤距离刻度线1~2㎝处。⑦改正:硫酸稀释后应冷却后再转移到容量瓶中。(2)容量瓶;(3)a.偏低; b.无影响;(4)a.重配;b.重配
本题解析:略
本题难度:简单
2、选择题 不能用排水法收集的气体是(? )
A.H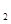
B.O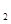
C.NO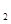
D.NO
参考答案:C
本题解析:3NO2+H2O=HNO3+NO,故NO2不能用排水法收集;由于NO2的密度比空气大,所以只能用向上排空气法来收集。其它选项的气体都不能溶解于水,也不能和水反应反应,所以都可以用排水法收集,也可以用排空气法收集。选项为C.
本题难度:一般
3、实验题 (14分)某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
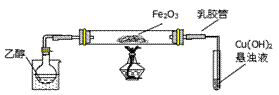
(1)为快速得到乙醇气体,可采取的方法是?;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 _________(填写编号);
a.取 下小试管 ?b.移去酒精灯
c.将导管从乳胶管中取下? d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中可能出现的现象为___________________。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+;
关于M 中铁元素价态的判断正确的是?(填写编号)。
a.一定有+3价和+2价铁,一定无0价铁? b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,一定无+2价铁? d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:
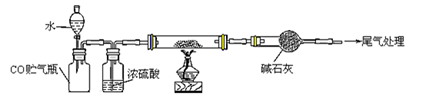
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是__________(填写编号)
a.①⑤④③②⑥⑦⑧? b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FeXOY中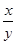 =_____。
=_____。
参考答案:(1)在烧杯中加入热水(对烧杯加热)(2分)? c? (2分)? (2)试管中出现砖红色沉淀(2分)
(3)?d? (2分)? (4)c? (2分)? (5) 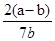 ?(4分)
?(4分)
本题解析:(1)乙醇的沸点比较低,只有78℃,因此为快速得到乙醇气体,可采取的方法是在烧杯中加入热水(对烧杯加热)。阻止倒吸的操作是迅速拆下导气管,因此若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是将导管从乳胶管中取下,答案选c。
(2)乙醇蒸气在氧化铁做催化剂作用下生成乙醛,试管内发生的是乙醛和氢氧化铜加热反应生成红色氧化亚铜沉淀,因此盛Cu(OH)2悬浊液的试管中可能出现的现象为试管中出现砖红色沉淀。
(3)M能被磁铁吸引,说明含有铁或四氧化三铁。由于反应后铁离子过量,因此即使有铁生成,也不可能与稀硫酸反应生成氢气,因此M 中铁元素价态是一定有+3和+2价铁,可能有0价铁,故答案选d。
(4)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c。
(5)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值,n(Fe):n(O)= ?=
?=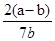 。
。
本题难度:一般
4、填空题 水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为?小时,最佳的浸出温度为?℃。

(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+?H2O+?Na2CO3=?Na2Fe6(SO4)4(OH)12↓+?Na2SO4+?CO2↑
(3)“除钙、镁”的原理反应为:MgSO4+2NaF=MgF2↓+Na2SO4 ;CaSO4+2NaF=CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10,Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 ?。
?。
(4)“沉淀”中含杂质离子主要有SO42-、F-、?和?;“操作X”包括?和?。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为LiCoO2+C6  CoO2+LiC6,写出该电池放电时的正极反应式?。
CoO2+LiC6,写出该电池放电时的正极反应式?。

参考答案:(16分)(1)12(2分),90(2分)
(2)3,6,6,1,5,6(2分)
3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑
(3)1.5(3分)
(4)NH4+(1分)、Na+(1分);洗涤(1分)、干燥(1分)
(5)CoO2 + Li+ + e-=LiCoO2(3分)
本题解析:(1)读图可知,升高温度,钴的浸出率逐渐增大,因此60℃时生产效率太低,90℃时的生产效率与120℃时的生产效率相差不明显,但是120℃时生产成本远远大于90℃时生产成本;因此最佳浸出温度为90℃,而最佳浸出时间为12h;(2)观察可知,该反应不涉及氧化还原反应,可以用设1法配平;设Na2Fe6(SO4)4(OH)12的系数为1,根据铁原子守恒可得Fe2(SO4)3的系数为3;根据硫原子守恒可得Na2SO4的系数为5,根据钠原子守恒可得Na2CO3的系数为6,根据碳原子守恒可得CO2的系数为6,根据氢原子守恒可得H2O的系数为6,即3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑;(3)c(Ca2+)/c(Mg2+)=[c(Ca2+)?c2(F-)]/[c(Mg2+)?c2(F-)]= Ksp(CaF2)/ Ksp(MgF2)=(1.11×10-10)/( 7.40×10-11)=1.5;(4)沉淀中所含杂质离子来自可溶性盐电离,可溶性盐来自沉淀步骤之前发生的反应,即加入稀硫酸酸浸时引入的硫酸根离子,加入碳酸钠除铁时引入的钠离子,加入氟化钠除去钙、镁时引入的氟离子,加入草酸铵沉淀钴离子时引入的铵根离子;除去四水合草酸钴沉淀中混有的可溶性物质,常用洗涤、干燥等操作;(5)放电时电池总反应为CoO2+LiC6=LiCoO2+C6,钴元素由+4降为+3价,锂元素由合金中的0升为+1价,则负极反应式为Li—e-=Li+,阳离子移向正极,则锂离子移向正极并参与正极上的反应,所以正极反应式为CoO2+ e-+ Li+= LiCoO2。
本题难度:一般
5、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
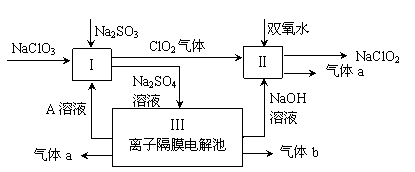
(1)双氧水的结构式为:?;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 ? 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因 ? 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 ?(填相同、不相同或无法判断)
参考答案:(14分)(1)H-O-0-H? Na2SO3 (各2分)
(2)2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O(2分)
(3)H2SO4 阳(2分)
(4)5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O。 (2分)
ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O(2分)
(5)相同(2分)
本题解析:⑴H2O2中两个氧原子间形成一个共用电子对,结构式为:H―O―O―H,反应I:2ClO3―+SO32―+2H+=2ClO2+SO42―+H2O,其中SO32―中S由+4价变成+6价,作还原剂,格答案为:H―O―O―H;Na2SO3 ;⑵从图中读出反应物为ClO2和H2O2,碱性条件,产物为NaClO2,ClO2作氧化剂,H2O2中氧由―1价变成―2,2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O,故答案:2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;⑶Ⅲ阳极:2H2O―4e―=4H+ +O2↑,a为O2,阴极:4H2O+4e―=4OH―?+2H2↑,?b为H2, A的化学式是H2SO4, 装置Ⅲ中A在阳极区产生,答案:H2SO4、阳;⑷Cl―浓度大时,还原性增强,被生成的ClO2氧化,5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O。答案为:5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑+ 2H2O、ClO2-+ 3Cl-+ 4H+ = 2Cl2+ 2H2O;⑸ClO2―、ClO3―与Fe2+ 反应最终都变成Cl―,变质前后转移的电子数相同,反以消耗Fe2+的物质的量相同。答案:相同。
本题难度:简单