微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的转化或分离错误的是(?)
A.煤干馏可转化为焦炉气、煤焦油、焦炭等
B.原油分馏可分离出汽油、煤油、柴油等
C.从海水中得到的无水MgCl2可用电解的方法获得镁
D.从碘水中得到碘,可用酒精萃取
参考答案:D
本题解析:略
本题难度:简单
2、实验题 无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
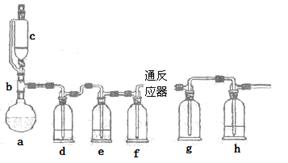
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式?。
(2)d、e盛装的药品分别是?和?,f、g的作用是?。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为?
②实验操作顺序是:组装仪器、?、装入药品、?、?、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
?
| 观察到的部分现象
|
第一次实验
| 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体
|
第二次实验
| 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体
|
第三次实验
| 反应器中有绿色晶体,g瓶有黄绿色气体
|
?
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是?。
②第二次实验,g瓶有红棕色的烟,其原因是?。
(5)第三次实验得到的固体,最可能含有微量杂质是?,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是?。
参考答案:(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O?(用次氯酸盐也可)
(2)饱和食盐水、浓硫酸?安全、防止倒吸?
(3) ①Fe+Cl2 ?FeCl2?②检验装置的气密性、先加热、 再打开c的活塞?
?FeCl2?②检验装置的气密性、先加热、 再打开c的活塞?
(4)①氯气没有干燥,生成的盐发生水解,生成了氢氧化物,最终分解得到三氧化二铁
②加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中
(5)铁单质?铁单质可以防止Fe2+被氧化
本题解析:
?
?试题分析:在实验室中在常温下一般用高锰酸钾溶液和浓盐酸发生反应来制取氯气。反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。(2)由于浓HCl有挥发性,而且反应是在溶液中制取的,所以氯气中含有杂质HCl和水蒸气。在d装置中用饱和的食盐水来除去HCl;在装置e盛装有浓硫酸来对氯气进行干燥。f、g的作用是作为安全瓶来防止倒吸现象的发生。(3)①纯净铁粉与氯气在500℃左右反应制取FeCl2。化学反应方程式为Fe+Cl2 FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
本题难度:一般
3、实验题 某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:
SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
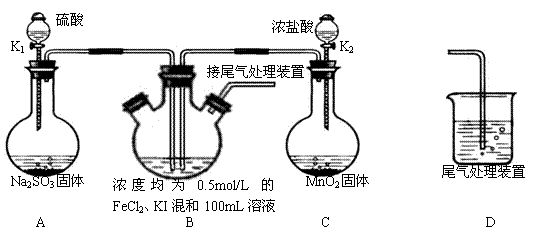
(1)上述实验需要加热的装置是
(2)D中,烧杯盛放的是
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式 ________________
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入 ________ 溶液,现象是
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是
A.关闭K2开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为 ?________?
参考答案:(13分 除第一空一分外其余每空二分)(1)C?(2)NaOH溶液
(3)2I-+ Cl2 =I2 + 2Cl-?淀粉溶液 溶液呈蓝色(或K(SCN)3溶液 溶液呈血红色)? A
(4)0.56L
本题解析:(1)实验室制备氯气需要加热,则需要加热的装置是C装置,答案选C。
(2)由于SO2和氯气都是大气污染物,需要尾气处理,所以D中烧杯盛放的氢氧化钠溶液。
(3)①由于碘离子的还原性强于亚铁离子,则氯气首先氧化的是碘离子,反应的离子方程式是2I-+ Cl2 =I2 + 2Cl- 。检验单质碘碘生成可以用淀粉溶液,实验现象是溶液呈蓝色。
②要比较SO2和I-的还原性强弱,则需要通过A装置制备SO2,所以正确的操作是关闭K2开K1,答案选A。
(4)碘离子和亚铁离子碘物质的量均是0.1L×0.5mol/L=0.05mol,通入SO2后,SO2分别将铁离子和单质碘还原为亚铁离子和碘离子,但由于铁离子的氧化性强于单质碘的,所以当Fe3+全部转化为Fe2+时,根据电子得失守恒可知,需要SO2的物质的量是0.05mol÷2=0.025mol,在标准状况下的体积是0.025mol×22.4L/mol=0.56L。2的制备、氧化还原反应的有关判断和计算、化学实验基本操作
点评:本题高考中的常见题型,属于中等难度的试题。试题基础性强,贴近高考,在注重对学生基础知识巩固和训练对同时,侧重对学生能力的培养,有利于培养学生规范严谨的实验设计能力和动手操作能力,也有助于提升学生的学科素养。
本题难度:一般
4、填空题 (12分)某同学用10mol? L-1 的浓盐酸配制250mL 1mol? L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl2 2.24L,则被氧化的HCl__________mol。
参考答案:(1)25?;(2)250mL容量瓶、胶头滴管;(3) MnO2 ;Cl2; 0.2
本题解析:(1)根据溶液稀释时溶质的质量不变,可计算出需要量取浓盐酸的体积为 。
。
(2)根据物质的量浓度配制要求,除量筒、烧杯、玻璃棒外,还必须用到的仪器是250mL容量瓶和胶头滴管。
(3)由方程式可知MnO2中Mn元素的化合价由+4价降低到+2价,被还原,作氧化剂,MnCl2是还原产物;HCl中Cl的化合价由-1价升高到0价,被氧化,作还原剂,Cl2是氧化产物。但4molHCl只有2mol作还原剂,另外2mol其酸性的作用。标准状况下的Cl2是2.24L,其物质的量是0.1mol,根据原子守恒知被氧化的HCl的物质的量是0.2mol。
本题难度:一般
5、填空题 (14分)某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:

回答下列问题:
(1)步骤(a)中,实验研磨孔雀石的仪器名称?;用硫酸浸取的化学方程式:?
(2)步骤(b)中,pH控制在3.O~3.5,其目的是?;加过氧化氢发生反应的离子方程式为?。
(3)怎样判断蒸发浓缩已完成:?。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表:
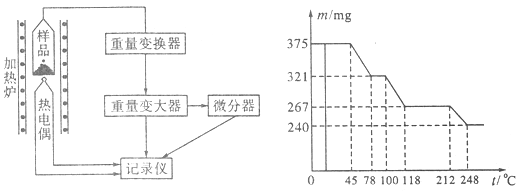
写出212~248℃温度范围内发生反应的化学方程式?。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为?mol·L-1。
参考答案:(1)研钵? Cu(OH)2·CuCO3+2H2SO4=2CuSO4+3H2O+CO2↑
(2)使Fe3+沉淀完全,而Cu2+仍留在母液中? 2Fe2++H2O2+2H+=2Fe3++2H2O
(3)当液面有晶体析出时即可说明蒸发浓缩已完成
(4) CuSO4·H2O CuSO4+H2O? (5) 4×lO一6
CuSO4+H2O? (5) 4×lO一6
本题解析:(1)固体研磨需要在研钵中进行。氢氧化铜或碳酸铜都能和硫酸反应,方程式为Cu(OH)2·CuCO3+2H2SO4=2CuSO4+3H2O+CO2↑。
(2)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。在pH=3.0~5.0的范围内铁离子能完全沉淀,而铁离子留在溶液中。
(3)蒸发时如果发现液面有晶体析出时,即可说明蒸发浓缩已完成。
(4)胆矾是375mg,物质的量是0.0015mol,其中水的质量是0.135mg。在221℃固体减少的质量是375mg-267mg=108mg,这说明减少的质量是水的质量,所以减少的水的物质的量是0.0015mol,所以此时固体是CuSO4·H2O,由212℃到248℃,固体又减少0.027mg,即此时固体中已经没有结晶水了,所以反应的方程式为CuSO4·H2O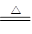 CuSO4+H2O。
CuSO4+H2O。
(5)等体积混合后,亚铁离子的浓度变为1×lO一5mol·L-1.根据溶度积常数的表达式可知c(CO32-)=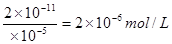 ,所以原碳酸钠溶液的浓度是4×lO一6mol/L。
,所以原碳酸钠溶液的浓度是4×lO一6mol/L。
本题难度:一般