微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L,求:
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度.
参考答案:达到平衡时,测得c(H2)=0.0080mol/L,则 H2(g)+I2(g)?

2HI(g)
? 起始时各物质的浓度(mol?L-1) 0.010 ?0.010 ?0
?各物质的浓度变化量(mol?L-1) 0.0020 0.0020 0.0040
?平衡时各物质的浓度(mol?L-1) 0.0080 0.0080 0.0040
(1)平衡时c(H2)=c(I2)=0.0080mol/L,c(HI)=0.0040mol/L,
则K=(0.0040)20.0080×0.0080=0.25,
答:该反应的平衡常数为0.25;
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L,
则?H2(g)+I2(g)?

2HI(g)
起始时各物质的浓度(mol?L-1) 0.02 ?0.02 0
各物质的浓度变化量(mol?L-1) x ?x ?2x
平衡时各物质的浓度(mol?L-1) 0.02-x 0.02-x ?2x
K=(2x)2(0.02-x)×(0.02-x)=0.25,
解得:x=0.004?mol/L,
所以平衡时c(HI)=0.008mol?L-1,
答:化学平衡时HI(g)的平衡浓度为0.008mol/L.
本题解析:
本题难度:一般
2、选择题 已经建立化学平衡的某可逆反应,当条件改变时化学平衡向正反应方向移动,下列叙述正确的是①生成物的质量分数一定增加 ②生成物的产量一定增加? ③反应物的转化率一定增加 ④反应物的浓度一定减小? ⑤正反应速率一定比逆反应速率大
A ①②③④⑤? B? ②④⑤? C ②⑤? D? ⑤
参考答案:C
本题解析:略
本题难度:简单
3、选择题 在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(气)+B(气)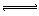 C(气)+D(气)
C(气)+D(气)
5 min后达到平衡。已知各物质的平衡浓度的关系为:
[A]a[B]=[C][D]</PGN0039A.TXT/PGN>
若在温度不变的情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为?
A.60%
B.40%
C.24%
D.4%
参考答案:B
本题解析:
容器体积扩大,但A转化率不变,可见反应前后总体积不变,因此a=1,方程式:
A(g)+ B(g) 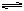 ?C(g)+? D(g)
?C(g)+? D(g)
起始量? 2? 3? 0? 0
变化量? x? x? x? x
平衡量? 2-x? 3-x? x? x
平衡时? [A][B]=[C][D]
∴(2-x)(3-x)=x2
∴x=1.2
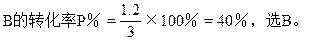
本题难度:一般
4、选择题 反应N2O4(g)  ?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(? )
?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是(? )
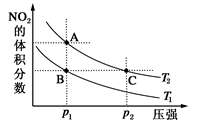
A.A、B两点的反应速率:A>B
B.B、C两点的反应平衡常数相同
C.由状态B到状态C,可以用加热的方法
D.A、C两点混合气体的平均相对分子质量:C>A
参考答案:AD
本题解析:由已知反应方程式可知,反应的正反应是吸热反应,所以温度升高平衡正向移动,NO2的体积分数增大,根据图像,压强相同时,A、B两点的NO2的体积分数A点更大,则说明温度T2>T1,温度越大反应速率越大,所以A正确;B、C两点的温度不同,所以平衡常数不相等,B错误;状态B和状态C不仅温度不同,压强也不同,所以仅通过加热方法不能实现状态B到状态C的转变,C错误;C相对于A增大了压强,压强增大平衡逆向移动,则气体的物质的量减小,气体总质量不变,所以平均相对分子质量增大,D正确;故选AD。
本题难度:一般
5、填空题 (18分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
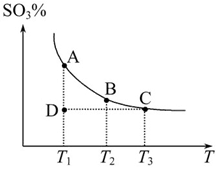
2SO2(g)+O2(g)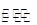 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)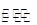 2SO3(g)的正反应为?反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为?反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
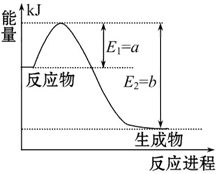
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4? mol·L-1硝酸银溶液,?白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
参考答案:(1)①放热(2分)?不(2分)
②> (2分)? >(2分)
(2)N2(g)+3H2(g)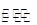 2NH3(g)?ΔH ="2(a-b)" kJ·mol-1(3分)
2NH3(g)?ΔH ="2(a-b)" kJ·mol-1(3分)
(3)有(1分)Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成(2分)
白色沉淀转化为黄色沉淀(2分)AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)(2分)
本题解析:(1)①由图可知,温度越高,三氧化硫的含量越低,平衡向左移动,正反应放热;恒温、恒容条件下充入氦气,体积增不变,正逆反应速率不变,所以平衡不移动。
②温度越高,平衡越向左移动,平衡常数越小,故 K1>K2。状态D未达到平衡状态,要达到平衡状态,三氧化硫的含量要增大,即平衡需要向右移动,故v(正)>v(逆)。
(2)由图像可知N2和H2反应生成1 mol NH3的反应热为-(b-a) kJ·mol-1,可得热化学方程式为:N2(g)+3H2(g)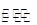 2NH3(g)? ΔH ="2(a-b)" kJ·mol-1
2NH3(g)? ΔH ="2(a-b)" kJ·mol-1
(3)通过计算比较浓度熵与Ksp的大小,Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成;沉淀向溶度积更小的方向转化,Ksp(AgCl)>Ksp(AgI),所以AgCl沉淀转化为更难溶的AgI,所以实验现象为白色沉淀转化为黄色沉淀;离子方程式为:AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)。
本题难度:一般