微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
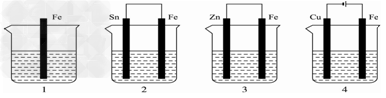
A.4>2>1>3
B.2>1>3>4?
C.4>2>3>1
D.3>2>4>1?
参考答案:A
本题解析:
本题难度:简单
2、填空题 下图中a为生铁,A烧杯中放入苯,B烧杯中为1 mol·L-1的稀硫酸,C烧杯中为海水。
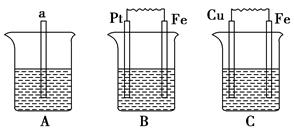
(1)B中Pt极的电极反应式为________。
(2)C中Cu极的电极反应式为________,Cu极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为________。
参考答案:(1)2H++2e-=H2↑
(2)2H2O+O2+4e-=4OH- 增大
(3)B>C>A
(4)酒精(或苯、四氯化碳等)
本题解析:(1)B中Pt极的电极反应式为2H++2e-=H2↑。(2)C中Cu极是正极,发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,Cu极附近溶液的pH增大。(3)由于Fe与Pt的活动性差距比Fe与Cu大,故B中反应速率快,而A中物质是苯,铁不易被腐蚀,故腐蚀速率由快到慢的顺序是B>C>A。(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为非电解质溶液,如酒精、苯、四氯化碳等。
本题难度:一般
3、选择题 (3分)(2012?山东)下列与金属腐蚀有关的说法正确的是( )
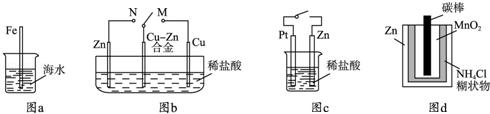
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
参考答案:B
本题解析:A.当溶液中氧气浓度越大时电化学腐蚀越严重;
B.开关由M改置于N时,Zn为负极,合金被保护;
C.气体在Pt上放出;
D.MnO2发生还原反应.
解:A.图a中,铁棒发生化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,故A错误;
B、图b中开关由M置于N,Cu﹣Zn作正极,腐蚀速率减小,故B正确;
C.图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;
D.图d中干电池放电时MnO2发生还原反应,体现锌的还原性,故D错误.
故选B.
点评:本题考查金属的腐蚀及防护,题目难度不大,注意把握原电池的工作原理.
本题难度:一般
4、简答题 (16分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是?。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______?__?。
(3)写出反应④生成沉淀X的离子方程式:
?。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
?。
(5)生成Li2CO3的化学反应方程式为______?__。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_?_。
参考答案:(1)增大接触面积,加快反应速率(2分)
(2)隔绝空气和水分(2分)
(3)CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–(3分)
(4)4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O(4分)
(5) Li2SO4+Na2CO3=Na2SO4+Li2CO3↓ (3分)?趁热过滤(2分)
本题解析:(1)进行粉碎操作可以增大反应物的接触面积,加快反应速率。
(2)锂是活泼的金属,极易和水及氧气反应,所以需要隔绝空气和水分。
(3)滤液中含有偏铝酸钠,所以通入CO2能生成氢氧化铝沉淀,方程式为CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–。
(4)LiMn2O4中Mn的化合价为+3和+4价,则+3价的被氧化生成二氧化锰,方程式为4 LiMn2O4+4 H++O2=8MnO2+4 Li++2H2O。
(5)Li2CO3的溶解度小于硫酸锂的,因此硫酸锂和碳酸钠反应可以生成碳酸锂沉淀,所以方程式为Li2SO4+Na2CO3=Na2SO4+Li2CO3↓。由于Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应趁热过滤。
本题难度:一般
5、选择题 下列关于金属腐蚀正确的是
[? ]
A.金属在潮湿的空气中腐蚀的实质是:M+nH2O==M(OH)n+n/2H2↑
B.金属的化学腐蚀的实质是:M-ne-=Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要正极上析出氢气为主
参考答案:BD
本题解析:
本题难度:简单