微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极主要发生的反应是
[? ]
A.2H++2e-=H2↑
B.2H2O+O2+4e-=4OH-
C.Fe-2e-=Fe2+
D.4OH--4e-=2H2O+O2↑
参考答案:A
本题解析:
本题难度:一般
2、选择题 关于金属腐蚀和防护的说法不正确的是
A.金属腐蚀过程中发生了化学反应
B.在铁表面镀锌可对铁起保护作用
C.在铁船壳上镶嵌铜块能减缓船体的腐蚀
D.铝制品在空气中不易被腐蚀,是因其表面形成了致密的氧化铝保护层
参考答案:C
本题解析:铁铜在一起可组成原电池,铁做为负极,腐蚀更快。
本题难度:一般
3、填空题 (8分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
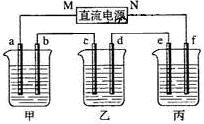
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为?;
(2)计算电极e上生成的气体在标准状态下的体积:?;
(3)电解后甲溶液的pH?(填“增大”、“减小”或“不变”),简述其原因:?;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
?。
参考答案:
(1)4OH--4e-=2H2O + O2↑(2分)
(2)5.6 L (2分)
(3)增大(1分)因为相当于电解水(1分)
(4)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应(2分)
本题解析:(1)乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。
(2)当乙中有16gCu析出时,转移的电子为0.5mol。而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。丙中为K2SO4,相当于电解水,由方程式2H2O 2H2↑+O2↑可知,生成2molH2,转移4mol电子,所以当整个反应中转移0.5mol电子时,生成的H2为0.25mol,标况下的体积为0.25mol×22.4L/mol=5.6L。
2H2↑+O2↑可知,生成2molH2,转移4mol电子,所以当整个反应中转移0.5mol电子时,生成的H2为0.25mol,标况下的体积为0.25mol×22.4L/mol=5.6L。
(3)甲中相当于电解水,故NaOH的浓度增大,pH变大。
(4)铜全部析出后,电解质变为H2SO4,所以电解反应仍能进行。
本题难度:一般
4、填空题 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置示意图如图所示。
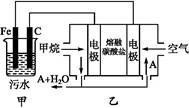
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时应向污水中加入适量的 。?
a.H2SO4 b.CH3CH2OH c.Na2SO4
d.NaOH e.BaSO4
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是Ⅰ. ;Ⅱ. 。?
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。?
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体 L(标准状况)。?
参考答案:(1)c (2)Fe-2e- Fe2+ 4OH--4e-
Fe2+ 4OH--4e- O2↑+2H2O (3)CO2 (4)8.96
O2↑+2H2O (3)CO2 (4)8.96
本题解析:H2SO4显酸性、CH3CH2OH是非电解质、NaOH显碱性、BaSO4不溶于水;Na2SO4是强电解质显中性,电解时Na+、S 均不放电,只有c符合;(2)乙装置通入空气的电极为原电池正极,所以甲装置Fe为阳极,铁失电子,由生成一种无色气体可知还生成氧气,所以还有OH-失电子;(3)由乙中电解质可知,甲烷燃烧生成CO2和H2O,所以A为CO2,在正极发生电极反应式为O2+4e-+2CO2
均不放电,只有c符合;(2)乙装置通入空气的电极为原电池正极,所以甲装置Fe为阳极,铁失电子,由生成一种无色气体可知还生成氧气,所以还有OH-失电子;(3)由乙中电解质可知,甲烷燃烧生成CO2和H2O,所以A为CO2,在正极发生电极反应式为O2+4e-+2CO2 2C
2C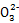 ;(4)首先标化合价看化合价变化:
;(4)首先标化合价看化合价变化: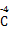 H4→
H4→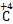 O2,0.1 mol CH4转移0.8 mol电子,C电极反应为2H++2e-
O2,0.1 mol CH4转移0.8 mol电子,C电极反应为2H++2e- H2↑,所以生成n(H2)="0.4" mol
H2↑,所以生成n(H2)="0.4" mol
本题难度:一般
5、简答题 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
(1)金属腐蚀主要分为______腐蚀和______腐蚀两种.
(2)铁被腐蚀的速率由快到慢的顺序是______(填序号).
(3)①中正极的电极反应式为______,②中负极的电极反应式为______.
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上.为防护金属被腐蚀可采取的措施有______(填序号).
①健身器材刷油漆?②自行车钢圈镀铬
③将钢管用导线与铜条连接?④将钢管用导线与碳棒连接.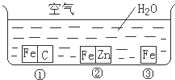
参考答案:(1)金属的腐蚀有:与化学物质直接反应的腐蚀和构成原电池而产生电流的腐蚀,所以分为化学腐蚀和电化学腐蚀,故答案为:化学;电化学;
(2)①中铁作原电池负极而能加快铁的腐蚀,②中铁作原电池正极而被保护,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,
故答案为:①>③>②;
(3)①中碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,②中锌作负极,负极上金属失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,
故答案为:2H2O+O2+4e-=4OH-;Zn-2e-=Zn2+;?
(4)①健身器材刷油漆能阻止金属构成原电池而被腐蚀,所以能防护金属被腐蚀,故正确;
②自行车钢圈镀铬,铬是不活泼金属,所以能防护金属被腐蚀,故正确;
③将钢管用导线与铜条连接,铁、铜和电解质溶液能构成原电池,铁作原电池负极而加快被腐蚀,所以不能防护金属被腐蚀,故错误;?
④将钢管用导线与碳棒连接,铁、碳和电解质溶液能构成原电池,铁作原电池负极而加快被腐蚀,所以不能防护金属被腐蚀,故错误;
故选 ①②.
本题解析:
本题难度:一般