| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《影响化学反应速率的因素》高频考点强化练习(2017年最新版)(六)
参考答案:AB 本题解析:升高温度反应加快,A对,加入少量CuSO4溶液会形成原电池,使反应加快,B对;浓硫酸和锌反应不能得到H2,C错,锌是固体,加入固体对反应物的浓度没有影响,故再加锌对反应没有影响,D错。 本题难度:一般 3、选择题 某探究小组利用丙酮的溴代反应(
分析实验数据所得出的结论不正确的是? [? ] A.增大 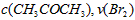 增大 增大 B.实验②和③的 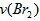 相等 相等C.增大 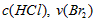 增大 增大 D.增大  , ,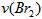 增大 增大 参考答案:D 本题解析: 本题难度:一般 4、选择题 在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+2B(g)? 参考答案:C 本题解析: 本题难度:简单 5、选择题 一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) 参考答案:C 本题解析:恒温扩大体积则气体的压强减小,平衡向气体总体积增大的方向移动。因原平衡时A的浓度为0.5 mol·L-1,当体积扩大两倍,假设平衡不移动,则A的浓度将变为0.25 mol·L-1,现新平衡时A的浓度为0.3 mol·L-1,说明平衡向生成A的方向移动了,即平衡向逆反应方向移动,所以x+y>z,则C的体积分数降低。 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《反应速率与.. | |