微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用锌粒与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A.升高反应体系的温度
B.增加锌粒的用量
C.不用锌粒,改用锌粉
D.加入少量浓硫酸
2、选择题 对于可逆反应2A+3B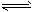 2C,△H<0,下列条件的改变一定可以加快正反应速率的是
2C,△H<0,下列条件的改变一定可以加快正反应速率的是
[? ]
A.增加压强
B.升高温度
C.增加A的量
D.加入二氧化锰作催化剂
3、填空题 (17分)Na、Cu、Al、O、C、H是常见的六种元素。
(1)Al位于元素周期表第_____周期第_____族;Cu的基态原子价电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能
| 离子半径
| 沸点
|
Na_______Al
| O2—_______Na+
| CH4______H2O
|
(3)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物 质
| CH4
| CO2
| CO
| H2
|
体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=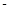 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="+2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=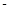 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________.

②为了提高该反应中CH4的转化率,可以采取的措施是__________________
(5)利用高温电解技术可将释放的CO2转化为具有工业利用价值的产品。
反应方程式为: ,其工作原理示意图如下:
,其工作原理示意图如下:

CO2在电极a放电的反应式是_______________________________
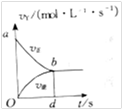
4、选择题 在某2L容积固定的密闭容器中,充入X、Y两种物质各2mol,有如下反应:3X(g)+Y(g)

2Z(g)发生,当反应达到平衡后,以Y的物质的量浓度改变表示的反应速率v正和?v逆与时间t的关系如图.则Y的平衡物质的量浓度的表达式(S指对应区域的面积)可表示为( )
A.2-SaOb
B.2-Sabd
C.1-SaOb
D.1-SbOd